Expertisecentrum
Het UMCG is sinds 2021 landelijk expertisecentrum voor onderzoek, diagnostiek en behandeling van het Hodgkin lymfoom. Hiertoe is een speciale Hodgkin lymfoom polikliniek opgericht waarbij patiënten binnen 1 week op één dag een intake krijgen bij de hematoloog en de radiotherapeut. Aansluitend zal een masker voor eventuele radiotherapie worden aangemeten en volgt een 4D FDG-PET/CT-scan in radiotherapie positie. Diezelfde week wordt patiënt inclusief (revisie van) de histologische diagnose en de beeldvorming besproken in het multidisciplinair overleg met een concreet behandeladvies. Hierop volgt terug verwijzing voor chemotherapeutische behandeling van het Hodgkin lymfoom naar de verwijzer of zal behandeling volledig in het UMCG plaatsvinden.
Diagnose
De diagnose Hodgkin lymfoom wordt gesteld op een lymfeklierexcisie of histologisch biopt. Bij de verdenking op een lymfoom is een cytologische punctie onvoldoende. Dit kan wel differentiëren bij verdenking op een carcinoom. Een hoge serum Thymus and Activation Regulated Chemokine (TARC) waarde (> 10 000 pg/ml) is zeer suggestief voor de diagnose Hodgkin lymfoom maar niet bewijzend. Onder andere ernstig actief eczeem en cutane lymfomen kunnen gepaard gaan met sterk verhoogde TARC waardes.
Subtypes
- Klassieke vormen Hodgkin lymfoom > 95%
- lymfocytenrijk;
- nodulair scleroserend ;
- gemengdcellig;
- lymfocytenarm.
- Nodulair lymfocytenrijke vorm (nodulair paragranuloom) < 5%
- Andere entiteit en behandeling dan klassieke vorm
Noodzakelijk onderzoek
- Revisie biopten door patholoog en beeldvormend onderzoek door radioloog (indien patiënt verwezen vanuit ander ziekenhuis);
- Volledig bloedbeeld, inclusief leukocyten differentiatie, BSE, TARC, bloedchemie, albumine, TSH, NT-proBNP, Trop-T, cholesterol, HbA1C (In UMCG Smartset: IHEM HODGKIN NP)
- FDG-PET/diagnostische CT-scan (met contrast) van hals, thorax, abdomen inclusief liezen;
- Indien al bekend stadium I/II of stadium onbekend zal 4D FDG-PET/CT in radiotherapie positie plaatsvinden na het aanmeten van een masker en voorlichting door de radiotherapeut
- Longfunctieonderzoek met diffusie capaciteit bij gebruik van bleomycine
- Hartfunctieonderzoek
- Er is geen indicatie meer voor beenmergdiagnostiek. De FDG-PET-scan is gevoeliger dan een beenmergbiopt ter vaststelling van beenmerg betrokkenheid van het Hodgkin lymfoom.
Stadiëring en risicoclassificatie
Stadiëring vindt plaats op basis van de FDG-PET-scan volgens de Lugano classificatie. (zie Maligne lymfomen: stadiëring en response evaluatie algemeen).
Voor het behandelplan wordt onderscheid gemaakt tussen beperkt stadium (stadium I/II) en gevorderd stadium (III/IV) Hodgkin lymfoom. Voor het beperkt stadium zijn een aantal risicofactoren opgesteld waarop de behandelkeuze is gebaseerd. Deze risicofactoren zijn afkomstig vanuit de originele EORTC risicoclassificatie en de GHSG risicoclassificatie. Hierbij zijn er kleine verschillen als het gaat om het aantal betrokken klierstations (2 bij GHSG en 3 bij EORTC) en het wel of niet betrekken van leeftijd als risicofactor (wel bij EORTC). Onderstaande tabel vat de risicofactoren samen.
Bij het gevorderd stadium wordt gebruik gemaakt van de International Prognostic Score (IPS, ook wel Hasenclever index). Deze heeft wel prognostische waarde, maar is van beperkte waarde bij de therapiekeuze in het gevorderd stadium.
Nodale gebieden
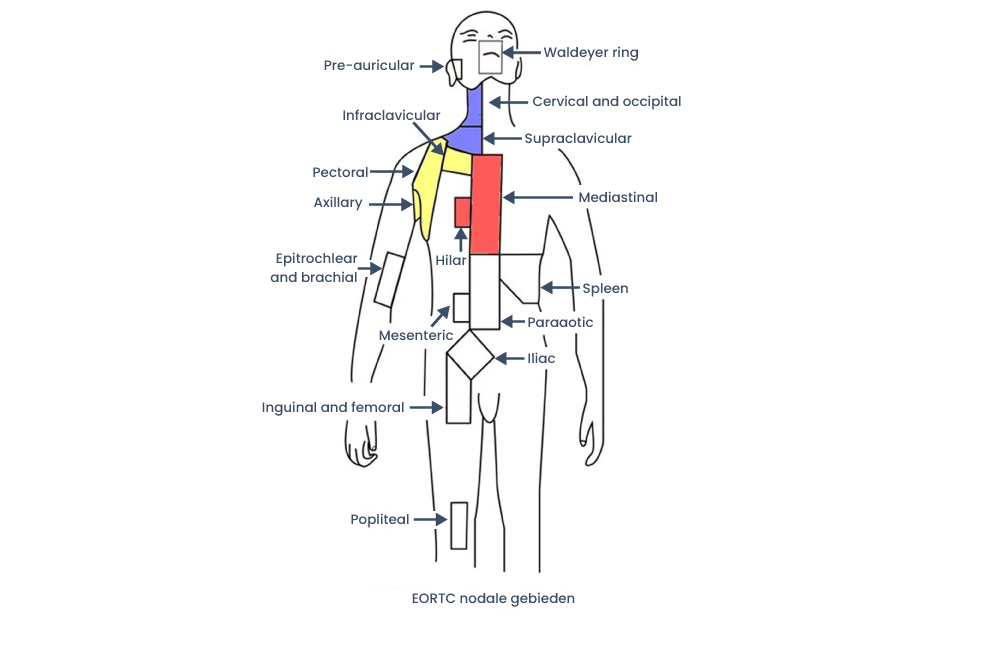
Figuur 1. Beschrijving van nodale gebieden voor beperkt stadium Hodgkin lymfoom
Risicofactoren beperkt stadium Hodgkin lymfoom
| Risicofactoren beperkt stadium | |
| Mediastinale bulk | ESR > 50 mm geen B-symptomen |
| Extranodale ziekte | ESR > 30 mm + B-symptomen |
| 3 nodale gebieden en > 50 jaar | > 3 nodale gebieden |
International prognostic score (IPS) gevorderd stadium Hodgkin lymfoom
| Factoren | Punten |
| leeftijd 45 of ouder | 1 |
| Man | 1 |
| stadium IV | 1 |
| Hb < 6.5 mmol/l | 1 |
| albumine < 40 g/l | 1 |
| leukocyten > 15 × 109/l | 1 |
| lymfocyten < 0.6 × 109/l of < 8% | 1 |
Vruchtbaarheid
- Indien gewenst voor behandeling verwijzen naar polikliniek fertiliteit voor semenpreservatie dan wel eicel-, embryo- of eierstokpreservatie (operatief).
- Bij mannen wordt bij alle stadia semenpreservatie aangeraden.
- Bij vrouwen wordt preservatie aangeraden bij gevorderd stadium en start van behandeling met escBEACODD. Kans op infertiliteit bij ABVD is beperkt. Zes kuren escBEACOPP geeft echter > 80% kans op infertiliteit, hoewel bij zeer jonge vrouwen (< 25 jaar) na enkele jaren herstel van vruchtbaarheid lijkt op te treden. Bij 2 kuren escBEACOPP lijkt er vaak behoud van fertiliteit te zijn, zeker wanneer dit op zeer jonge leeftijd (< 25 jaar) wordt toegepast. Boven de 35 jaar is het waarschijnlijk dat 2 kuren eBEACOPP niet zal lijden tot herstel van vruchtbaarheid. Hoewel er bij het Hodgkin lymfoom vaak voldoende tijd is voor vruchtbaarheid preserverende maatregelen dient het belang hiervan altijd afgewogen te worden tegen de risico’s van vertraging bij start van de behandeling (bij vrouwen 3-4 weken). Bij vrouwen die orale anticonceptie gebruiken deze niet staken voor bezoek aan de fertiliteitspolikliniek. Nu de escBEACOPP kuren zijn vervangen voor escBEACODD kuren waarbij de procarbazine is vervangen door dacarbazine zijn de te verwachten negatieve effecten op de vruchtbaarheid waarschijnlijk van kleiner belang.
Behandeling
Beperkt stadium < 60 jaar
Algemeen:
- Patiënt dient voor de start van chemotherapie op de Hodgkin polikliniek in het UMCG te worden gezien door de radiotherapeut. Dit is van essentieel belang voor het maken van een radiotherapeutische FDG-PET/CT ten behoeve van involved node radiotherapie en selectie voor protonen radiotherapie.
- Een normalisatie van serum TARC < 1000 pg/ml na 1 kuur is sterk voorspellend voor responsieve ziekte en een negatieve interim PET-scan.
- Alle behandelschema’s bevatten een interim PET-scan na 2 kuren chemotherapie waarop verdere therapie gestuurd wordt.
- Begin 2023 zal de EORTC RADAR studie starten waarbij gerandomiseerd wordt tussen standaardbehandeling ABVD en behandeling waarbij Brentuximab-vedotin gecombineerd wordt met AVD chemotherapie.
Zonder risicofactoren buiten studieverband
- Zie figuur 2 voor een flowdiagram voor behandeling buiten studieverband.
- Er wordt gestart met 2 ABVD kuren, waarna een interim PET (zonder diagnostische CT) volgt.
- Bij een positieve interim FDG-PET-scan na 2 cycli ABVD (Deauville 4 of 5) is gebleken dat escalatie naar 2 escBEACOPP plus INRT een verbetering geeft van de progressievrije overleving met ca. 13% (Andre et al. 2017).
- Bij een negatieve PET-scan (Deauville 1-3) wordt bij patiënten met 1 of 2 lymfeklierregio’s de behandeling geconsolideerd met 20 Gy involved node radiotherapie (volgens HD10 studie).
- Bij een negatieve PET-scan (Deauville 1-3) bij patiënten met 3 aangedane lymfeklierregio’s en jonger dan 50 jaar volgt nog 1 aanvullende AVD kuur (volgens H10 studie). Op basis van extrapolatie van gegevens uit het gevorderd stadium Hodgkin lymfoom kan na 2 ABVD kuren en een negatieve PET de bleomycine worden weggelaten zonder verwacht verlies van progressievrije overleving.
Behandeloverzicht beperkt stadium zonder risicofactoren
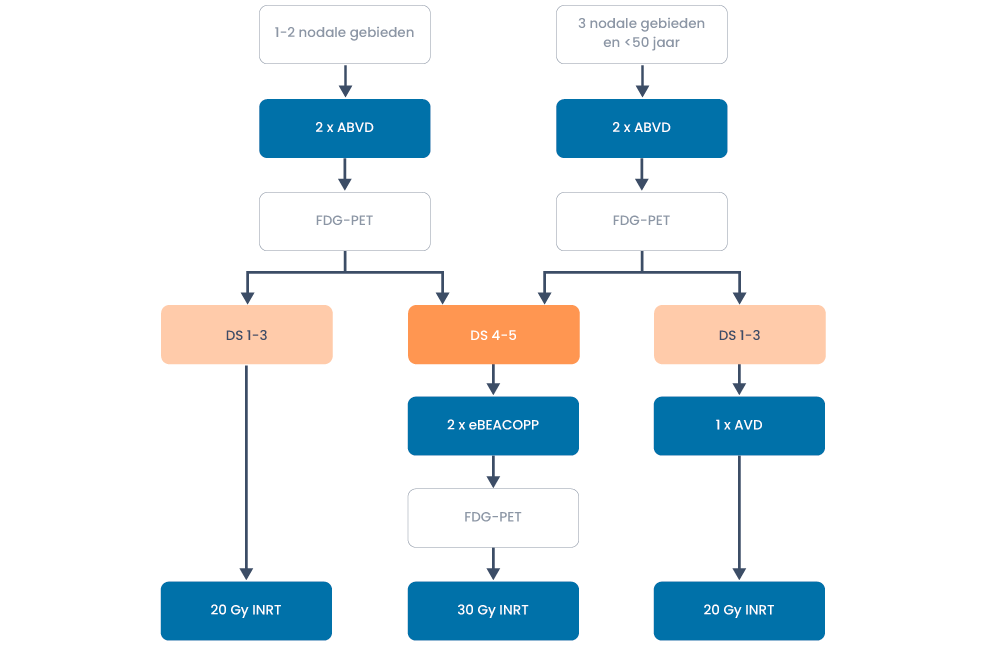
Figuur 2. Behandeling van vroeg stadium Hodgkin lymfoom zonder risicofactoren buiten studieverband
Met risicofactoren buiten studieverband
- Zie figuur 3 voor een flowdiagram.
- Voor patiënten met risicofactoren dient een afweging gemaakt te worden tussen ABVD en eBEACOPP gebaseerde behandeling (modificatie van de HD17 studie).
- Beide behandelstrategieën hebben een uitstekende effectiviteit met een verwachte progressievrije overleving van 93% of hoger. De keuze dient derhalve gemaakt te worden op basis van een afweging van de toxiciteit van de behandeling en is individueel bepaald.
- De keuze tussen beide behandelstrategieën wordt met name bepaald door de wenselijkheid van toepassen van radiotherapie.
- Bij vooraf vastgestelde onwenselijkheid tot toepassen van radiotherapie is de eBEACOPP gebaseerde strategie een logische keuze. Hierbij heeft ca. 85% van de patiënten een negatieve PET-scan na 2 kuren en volstaat behandeling met nog 2 aanvullende A(B)VD kuren zonder aanvullende radiotherapie.
- In geval van een positieve interim FDG-PET-scan (Deauville score 4/5) maar wel een partiële respons wordt behandeling gecontinueerd met eBEACOPP kuren tot 6 kuren conform gevorderd stadium waarbij radiotherapie alleen wordt toegepast op resterende FDG-avide laesies na afloop van de chemotherapeutische behandeling.
- Een andere belangrijke wegingsfactor is de vruchtbaarheid. Bij ABVD is er vaak behoud van vruchtbaarheid. Twee kuren eBEACOPP gaan bij jonge vrouwen (< 25 jaar) over het algemeen gepaard met herstel van vruchtbaarheid na enkele jaren. Het risico op (blijvende) onvruchtbaarheid wordt groter bij toepassing van 4 tot 6 kuren eBEACOPP en dient derhalve vooraf met patiënt te worden besproken.
- In geval van sterke wens tot natuurlijk behoud van vruchtbaarheid is de ABVD gebaseerde strategie een goede behandeloptie. Bij onwenselijkheid tot radiotherapie te continueren tot 6 kuren conform gevorderd stadium.
Behandeloverzicht beperkt stadium met risicofactoren
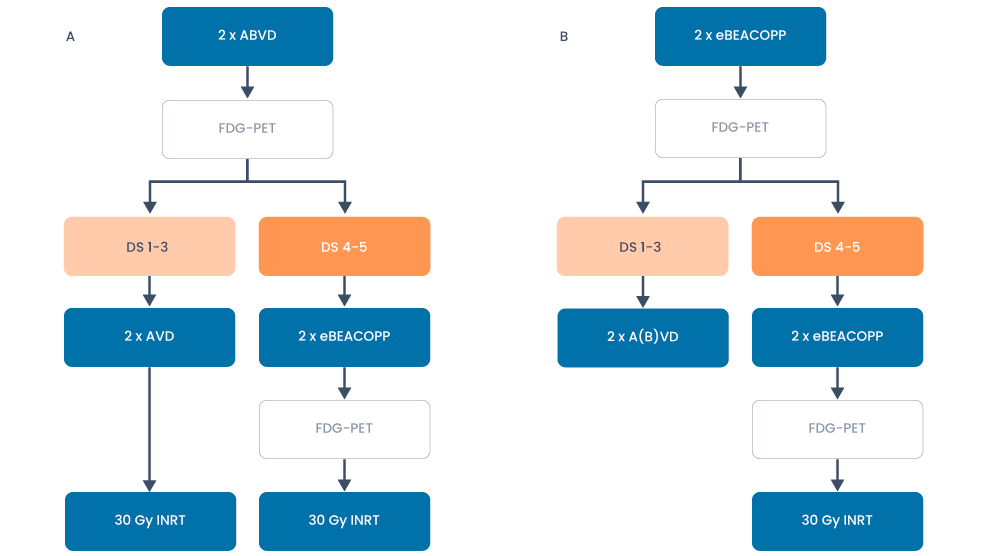
Figuur 3. Behandeling van vroeg stadium Hodgkin lymfoom met risicofactoren buiten studieverband waarbij gestart kan worden met ABVD (schema A) of eBEACOPP (schema B).
N.B. In het UMCG is het eBEACOPP schema aangepast waarbij de procarbazine is vervangen door dacarbazine (en prednisolon door dexamethason). Dit op basis van Engelse real-world data die vergelijkbare effectiviteit maar minder hematologische toxiciteit, gonadale toxiciteit en stamceltoxiciteit met zich meebrengt. Het moederprotocol voor dit schema is hier te vinden : eBEACOD-Dac moederprotocol.
Gevorderd stadium < 60 jaar
- Bij gevorderde stadia III en IV wordt in principe gekozen voor primair curatieve chemotherapie en wordt radiotherapie alleen gegeven op de na afronding van chemotherapie nog aanwezige FDG-PET-positieve laesies (Deauville score 4/5).
- Zowel chemotherapeutische behandeling met ABVD als escBEACOPP zijn goede opties. Beide modaliteiten dienen gestuurd te worden op de interim FDG-PET-scan na 2 kuren.
- Voor patiënten met stadium IV ziekte heeft behandeling met Brentuximab-AVD de voorkeur boven ABVD behandeling. Boven de 50 jaar heeft dit gezien de lagere therapie gerelateerde toxiciteit ook de voorkeur boven eBEACOPP (zie verder).
- De chemotherapiekeuze is afhankelijk van leeftijd, comorbiditeit, belang van fertiliteit, korte en lange termijn toxiciteit en wens van de patiënt. De progressievrije overleving van starten met escBEACOPP (ca. 91%) is bij gevorderd Hodgkin lymfoom beter dan PET-gestuurde behandeling met start van ABVD (ca. 78%) of BrAVD (83%). Daarentegen is eBEACOPP toxischer (met frequent verlies van fertiliteit) en dient niet te worden gegeven aan patiënten ouder dan 60 jaar of patiënten boven de 40 jaar met een ECOG performance > 2. In een Cochrane analyse lijkt er ook voor overall survival een licht voordeel te zijn van niet PET-gestuurde eBEACOPP t.o.v. niet PET-gestuurde ABVD van ca. 3%. Voor de PET-gestuurde ABVD en BrAVD is het aannemelijk dat dit verschil kleiner is.
- Indien met ABVD gestart wordt, dan kan zowel gede-escaleerd als geëscaleerd worden op basis van de FDG-PET-scan na 2 kuren. Bij een negatieve FDG-PET-scan (Deauville 1-3) kan de bleomycine in de 4 daaropvolgende cycli zonder verlies van progressievrije overleving weggelaten worden. Bij een positieve FDG-PET-scan (Deauville 4-5) dient de behandeling geïntensiveerd te worden naar eBEACOPP gezien de betere progressievrije overleving bij deze patiëntengroep ten opzichte historische data met continueren van ABVD (Johnson et al, 2016).
- Indien met eBEACOPP gestart wordt kan bij een negatieve FDG-PET (Deauville 1-3) volstaan worden met nog 2 kuren eBEACOPP (in totaal 4). Bij FDG-PET positiviteit (Deauville 4/5) dienen nog 4 kuren gegeven te worden tot in totaal 6 kuren (Borchman et al, 2017).
- Voor patiënten met stadium IV ziekte (vergoeding alleen voor stadium IV) is behandeling met Brentuximab-AVD (BrAVD) een goede behandeloptie. Ten opzichte van ABVD kuren is er een ca. 5% progressievrij overlevingsvoordeel (Echelon-1 studie). De ABVD behandeling werd in deze studie echter niet geëscaleerd naar eBEACOPP in geval van een positieve interim PET-scan. BrAVD behandeling gaat gepaard met een hogere incidentie van polyneuropathie en (febriele) neutropenie. Ondersteuning met G-CSF is derhalve een vereiste. Ook de kosten zijn aanzienlijk hoger. Er is echter sprake van minder pulmonale toxiciteit aangezien er geen bleomycine in het behandelschema is verwerkt. Dit schema is daarom aantrekkelijk voor patiënten met stadium IV ziekte waarbij er een contra-indicatie is voor bleomycine behandeling. Ook bij comorbiditeit of een leeftijd > 50 jaar heeft BrAVD de voorkeur boven eBEACOPP gezien de hogere toxiciteit van eBEACOPP kuren bij deze patiëntengroep.
- Na afloop van de chemotherapeutische behandeling dient altijd een FDG-PET-scan herhaald te worden, ook als er sprake is van een negatieve interim PET-scan. Bij een negatieve PET na 2 cycli ABVD is het recidiefrisico voor stadium II, III en IV patiënten respectievelijk 10%, 18% en 20% waarbij een deel van deze patiënten progressie laat zien tijdens de laatste cycli AVD.
- Indien na afloop van de chemotherapeutische behandeling nog steeds PET-positieve laesies bestaan, dan is er een indicatie voor bestraling van deze laesies met 36Gy.
- Bij progressie na een negatieve interim FDG-PET-scan kan bestraling van een enkele en/of beperkte laesies of salvage therapie overwogen worden.
Behandeloverzicht gevorderd stadium < 60 jaar
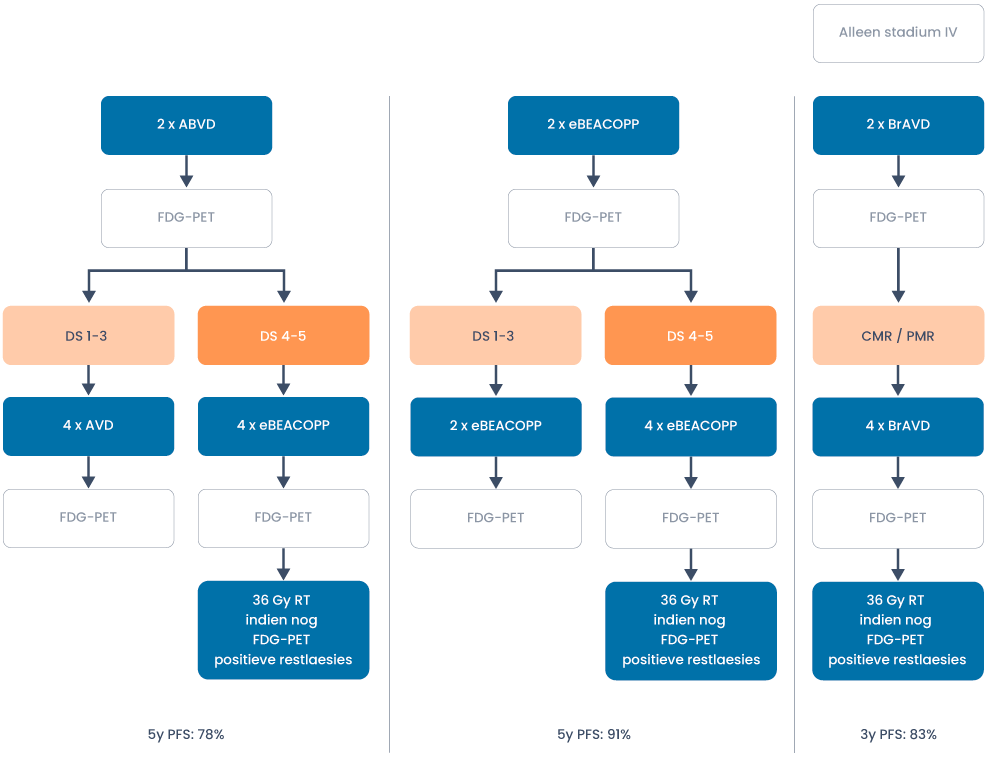
Refractair/recidief
Refractair of eerste recidief
- Voorkeur voor behandeling binnen de HOVON 164 studie: hierbij wordt de checkpointremmer tislelizumab gecombineerd met gemcitabine en cisplatinum. Bij bereiken van een vroege complete respons zal behandeling met intensieve chemotherapie en autologe stamceltransplantatie vervangen worden door een extra kuur tislelizumab GP en onderhoudsbehandeling met tislelizumab: HOVON 164 studie.
- Buiten studieverband komen fitte patiënten met een recidief Hodgkin lymfoom in aanmerking voor salvage chemotherapie met 3 salvage kuren, bij respons gevolgd door BEAM en autologe stamceltransplantatie.
- Salvage therapie van voorkeur voor patiënten die niet refractair zijn voor brentuximab is het BV-DHAP schema gezien de hogere complete metabole respons rate en betere progressievrije overleving van dit schema vergeleken met historische resultaten met DHAP zonder brentuximab-vedotin. Voor primair refractaire patiënten is dit minder evident. Een goed alternatief is het GDP schema.
- Na 2 salvage kuren wordt een FDG-PET-scan herhaald. Het behalen van een negatieve FDG-PET na salvage therapie gaat gepaard met een uitstekende prognose na consolidatie met hoge dosis chemotherapie (BEAM) en autologe stamcelsupport. Bij een metabole CR en ruime PR wordt therapie derhalve gecontinueerd met een 3e salvage kuur gevolgd door BEAM en ASCT.
- Bij non-responsieve ziekte (PR of minder) op salvage chemotherapie zijn er de afgelopen jaren verschillende mogelijkheden ontstaan:
- Behandeling met pembrolizumab is de behandeling van voorkeur gezien de betere ORR (66%) t.o.v. brentuximab-vedotin (54%) en betere PFS (mediaan 13 vs. 8 maanden) in de vergelijkende Keynote 204 studie. Tevens zal brentuximab-vedotin veelal in de eerste of tweede lijn al zijn toegepast.
- Indien er nog geen brentuximab-vedotin is gegeven bij salvage chemotherapie vormt bij uitgebreide chemo-refractaire ziekte brentuximab-vedotin de voorkeur om te gebruiken als bridge naar evt. allogene stamceltransplantatie.
- Een andere optie is mini-BEAM chemotherapie. Ervaring vanuit het UMCG leert dat ook dit een ORR geeft van ca. 67% als toegepast als second salvage na DHAP of BV-DHAP.
- Bij het alsnog bereiken van metabole CR of een ruime PR is het advies om alsnog te consolideren met BEAM en ASCT gezien de beperkte mediane PFS van monotherapie met pembrolizumab (13 maanden) of brentuximab-vedotin (8 maanden).
- Een alternatief bij uitgebreide chemo-refractaire ziekte is consolidatie met een allogene stamceltransplantatie. Het is echter wenselijk om de laatste gift pembrolizumab minimaal 8 weken maar het liefst 12 weken voor de allogene stamceltransplantatie gestaakt te hebben gezien het hogere risico op aGVHD.
- Patiënten die voor BEAM en ASCT geen metabole complete respons bereiken komen in aanmerking voor evt. radiotherapie op nog persisterende ziekte na ASCT én onderhoudsbehandeling met brentuximab-vedotin tot maximaal 16 cycli.
2e en latere recidief
- Bij een recidief na ASCT zijn brentuximab-vedotin, pembrolizumab en nivolumab allen geregistreerd en goede behandelopties. Gezien de korte mediane duur van respons (ca. 6-12 maanden) dient bij voldoende respons en beschikbaarheid van een adequate donor een allogene stamceltransplantatie ter consolidatie overwogen te worden.
- Ook bendamustine kan een effectieve bridge naar allogene stamceltransplantatie vormen.
- In het UMCG heeft een haplo-transplantatie met totale lichaamsbestraling als conditionering en post-transplantatie cyclofosfamide bij het Hodgkin lymfoom de voorkeur.
- Alternatieve strategieën bij ongeschiktheid voor allogene stamceltransplantatie zijn doorbehandelen met brentuximab, pembrolizumab of nivolumab.
- Bij een recidief na allogene stamceltransplantatie is herbehandelen met pembrolizumab een optie met goede response rates. Dit gaat echter gepaard met een hoge incidentie van aGVHD van ca. 20% en moet met uiterste terughoudendheid worden toegepast.
Eerste lijn Hodgkin lymfoom > 60 jaar
- Bij voorkeur behandeling binnen studieverband. Er wordt binnen de EORTC gewerkt aan een studie voor niet fitte of oudere patiënten.
- Patiënten tussen de 60-70 jaar met beperkte comorbiditeit wordt behandeling volgens patiënten < 60 jaar met ABVD geadviseerd waarbij geen escalatie naar escBEACOPP zal plaatsvinden op basis van de hogere acute toxiciteit en mortaliteit bij escBEACOPP boven de 60 jaar. Voor patiënten met stadium IV ziekte heeft BrAVD de voorkeur.
- Boven de 70 jaar is therapie afhankelijk van de performance en de aanwezigheid van comorbiditeit. ABVD is vaak te toxisch, vooral pulmonaal (bleomycine) en of cardiaal (doxorubicine). Bij goede cardiale functie is doxorubicine bevattende chemotherapie de eerste keus, waarmee AVD chemotherapie een betere OS lijkt te geven dan CHOP chemotherapie. Voor patiënten die ook niet fit genoeg worden geacht voor AVD chemotherapie zijn mini-AVD, PECC, gemcitabine monotherapie of alleen radiotherapie opties.
Recidief of refractair Hodgkin niet fitte patiënten
- Bij patiënten die niet fit zijn voor salvage chemotherapie inclusief hoge dosis chemotherapie kan gekozen worden voor therapie met bijvoorbeeld GDP zonder hoge dosis therapie, PECC, LOPP of beperkte radiotherapie.
- Brentuximab-vedotin is geregistreerd als monotherapie voor niet fitte patiënten na 2 eerdere voorafgaande therapieën en worden goed verdragen in deze patiëntencategorie.
- Bij recidief of refractaire ziekte na brentuximab-vedotin is pembrolizumab geregistreerd. Dit is een goed verdraagbaar alternatief ook bij de niet fitte patiëntencategorie.
- Aantrekkelijk alternatief salvage schema in fase II studies met Brentuximab-vedotin (op dag 1) i.c.m. bendamustine (70 mg/m2) op dag 1 en dag 2. Dit is een weinig toxisch en goed alternatief met ca. 80% CR na 3 kuren. Bendamustine wordt echter nog niet vergoed in deze situatie.
Therapie nodulair lymfocytenrijke Hodgkin (nodulair paragranuloom)
De nodulaire vorm van de lymfocytenrijke (LP) subgroep (< 5%) is een ander ziektebeeld (nodulair paragranuloom) en wordt niet standaard als Hodgkin lymfoom behandeld. Er bestaat bij dit type een levenslang risico op recidief. Bovendien is er kans op ontaarding naar een grootcellig NHL.
Behandeladvies
Bij stadium I en beperkt stadium II is in opzet curatieve radiotherapie conform het folliculair lymfoom een goede behandeloptie. Bij alle overige stadia is een wait-and-see beleid indien patiënt asymptomatisch is en het beloop indolent is aangewezen. Bij extranodale of milt betrokkenheid bestaat er een verhoogd risico op transformatie naar een grootcellig NHL en derhalve een zekere behandelindicatie.
Indien behandelindicatie:
Stadium I en complete resectie: wait and see of IN-RT.
Stadium I-II: IN-RT al dan niet combineren met chemotherapie ter debulking
Stadium III en IV: behandeling met 6× R-CHOP heeft de voorkeur boven 6× R-ABVD. Beide therapieën lijken vergelijkbaar qua effectiviteit waarbij R-CHOP gepaard gaat met een lagere toxiciteit zeker bij de oudere patiënt. Daarnaast is in geval van twijfel over transformatie naar een grootcellig B-cel lymfoom dit een adequate therapie.
Recidief nodulair paragranuloom: individualiseren. Monotherapie met rituximab (4 giften in 4 weken) heeft een hoge ORR maar recidieven zijn universeel. Evt. wel effectief te combineren met radiotherapie of chemotherapie conform het klassieke Hodgkin lymfoom. Salvage chemotherapie en autologe stamceltransplantatie is geïndiceerd bij snel en/of uitgebreid recidief.
Follow-up
De controles direct na de eerstelijnsbehandeling zijn gericht op herstel na therapie en screenen op recidief. TARC bepaling is een adequate manier om de ziekte te monitoren, waarbij TARC < 1000 pg/ml past bij een persisterende remissie na behandeling. TARC waardes > 1000 pg/ml bij afwezigheid van actief eczeem zijn erg suggestief voor recidief ziekte waarbij aanvullende beeldvorming met PET/CT is geïndiceerd.
Frequentie van poliklinische controle na einde behandeling in het UMCG:
- Jaar 1: eenmaal per 3 maanden
- Jaar 2: eenmaal per 4 maanden
- Jaar 3: 1 maal per 4 maanden (i.p. eenmaal bij hematoloog)
- Jaar 4 en 5: 1 maal per 6 maanden
- Daarna volgens schema lange termijn follow-up
Lange termijn follow-up
Lange termijn follow-up is vooral gericht op detectie en preventie van late schade door de behandeling. Zie Late complicaties ten gevolge van therapie Hodgkin of Non-Hodgkin lymfoom. De richtlijnen van het BETER consortium (www.beternahodgkin.nl) worden hierbij gevolgd. Belangrijke elementen hierbij zijn:
Na radiotherapie schildklierregio (hals, mediastinum): eens per jaar schildklierhormoon controle, tevens palpatie schildklier (omvang, noduli)
Bij vrouwen (leeftijd ten tijde therapie < 40 jaar) waarbij de mammae strooistraling door bestralingsveld hebben gekregen (mediastinale en of axillaire radiotherapie): vanaf 8 jaar na radiotherapie maar niet voor het 30e levensjaar starten met jaarlijkse MRI én mammografie (zie tabel)
| Leeftijd | 25-30 | 30-60 | 60-70 | 70-75 |
| Klinisch borstonderzoek | Jaarlijks | Jaarlijks | elke 2 jaar | – |
| MRI | Jaarlijks | Jaarlijks | – | – |
| Mammografie (polikliniek) | – | Jaarlijks | elke 2 jaar | – |
| Mammografie (bevolkingsonderzoek) | – | – | – | elke 2 jaar |
Na radiotherapie op het mediastinum letten op risicofactoren voor coronairlijden: roken, hypertensie, diabetes, overgewicht en hyperlipidemie. Na 5 en 15 jaar ECG, echografie voor klepdysfunctie (radiotherapie) en ejectiefractie (antracyclines). Jaarlijks NT-proBNP
Na radiotherapie buik: alert zijn op gastro-intestinale tumoren, nierfunctie vervolgen en bloeddrukcontrole.
Alert zijn op nieuw lymfoom (NHL).
Voor vragen betreffende fertiliteit vroegtijdige verwijzing naar de gynaecoloog.
Vrouwen die na behandeling vroegtijdig in de overgang zijn gekomen dienen oestrogeensubstitutie te krijgen ter preventie van osteoporose (zie Infertiliteit en hormonale insufficiëntie na chemo- en radiotherapie).
Bij patiënten waarin het verleden een splenectomie of radiotherapie op de milt(hilus) heeft plaatsgevonden dient aandacht besteed te worden aan de infectiepreventie en vaccinatie (zie Infectiepreventie/vaccinatie bij splenectomie en hyposplenisme).
Chemotherapieschema’s
In het algemeen:
- Bij ABVD is neutropenie geen indicatie voor uitstel of dosisreductie
- Stel kuren zo min mogelijk uit en doseer optimaal zie voor aanpassing onderstaande schema’s
- Overweeg implantatie VAP/ PICC
- Escalated BEACOPP is een intensieve kuur, die alleen moet worden gegeven aan patiënten jonger dan 60 jaar. Bij de eerste kuur dient patiënt te worden opgenomen, de verdere kuren kunnen meestal poliklinisch worden gegeven
- Vincristine en vinblastine zijn neurotoxisch, aanpassing van de dosis op basis van perifere neuropathie kan nodig zijn
- Bleomycine kan longtoxiciteit veroorzaken. Pulmonale klachten kunnen subtiel beginnen met een prikkelhoest. Vastleggen van de diffusiecapaciteit voor start van de behandeling en bewaking tijdens de behandeling is gewenst. Bij daling van de diffusiecapaciteit en of pulmonale klachten of afwijkingen dient de bleomycine te worden weggelaten uit het chemotherapieschema.
ABVD
| ABVD: frequentie: 1 × per 4 weken | |||
| Adriamycine | 25 mg/m2 | i.v. | dag 1 en dag 15 |
| Bleomycine | 10 USP-E /m2 | i.v. of i.m. | dag 1 en dag 15 |
| Vinblastine | 6 mg/m2 | i.v. | dag 1 en dag 15 |
| Dacarbazine | 375 mg/m2 | i.v. | dag 1 en dag 15 |
Modificatie van de dosering op geleide van bloedbeeld wordt niet meer geadviseerd. In principe continueren met 100% dosering. Gebruik van hematopoëtische groeifactoren (G-CSF) is toegestaan. NOOIT samen met de cytostatica, dus pas starten 1 dag ná kuur.
Brentuximab-AVD (BrAVD)
| ABVD: frequentie: 1 × per 4 weken | |||
| Brentuximab-vedotin | 1,2 mg/kg
(max 120 mg) |
i.v. | dag 1 en dag 15 |
| Adriamycine | 25 mg/m2 | i.v. | dag 1 en dag 15 |
| Vinblastine | 6 mg/m2 | i.v. | dag 1 en dag 15 |
| Dacarbazine | 375 mg/m2 | i.v. | dag 1 en dag 15 |
Het is verplicht om bij de BrAVD toe te voegen:
- G-CSF: peg-filgrastim (Neulasta, 6 mg, één injectie op dag 5 en 19).
Dosismodificatie:
- Na het bereiken van een metabole complete respons na 2 kuren is het verstandig laagdrempelig de vinblastine dosis te halveren of zelfs te staken om verdere progressie van polyneuropathie te voorkomen
- Bij neuropathie graad 2 dosis van brentuximab-vedotin verminderen naar 0,9 mg/kg.
- Neuropathie ten gevolge van brentuximab-vedotin is veelal reversibel
Escalated BEACOPP
Alleen voor patiënten < 60 jaar zonder of beperkte comorbiditeit
| Escalated BEACOPP: frequentie 1 × per 3 weken | |||
| Cyclofosfamide | 1250 mg/m2 | i.v. | Dag 1 |
| Adriamycine | 35 mg/m2 | i.v. | Dag 1 |
| Vincristine | 1,4 mg/m2 | i.v., max 2 mg | Dag 8 |
| Bleomycine | 10 USP-E (= mg)/m2 | i.v. of i.m. | Dag 8 |
| Etoposide | 200 mg/m2 | i.v. | Dag 1, 2 en 3 |
| Procarbazine | 100 mg/m2 | p.o. | Dag 1 t/m 7 |
| Prednisolon | 40 mg/m2 | p.o. | Dag 1 t/m 14 |
Het is verplicht om bij de escalated BEACOPP toe te voegen:
- G-CSF: peg-filgrastim (Neulasta, 6 mg, één injectie op dag 4).
- Pneumocystis J profylaxe: 1dd 480 mg tot 1 maand na de volledige behandeling
- Gram negatieve profylaxe ciprofloxacin 2dd 500 mg p.o.
De volgende Escalated BEACOPP wordt gegeven op dag 22 van de voorafgaande kuur, mits het bloedbeeld is hersteld boven de volgende kritische waarden:
- Leuco’s > 2.5 × 109/l
- Neutrofiele granulocyten > 1.5 × 109/l
- Thrombo’s > 80 × 109/l
Indien het bloedbeeld niet is hersteld volgt uitstel van de kuur en controle van het bloedbeeld na 3, 7, 10 en 14 dagen. Zodra het bloedbeeld is hersteld boven de kritische waarden, dan volgt de volgende kuur. Dosisaanpassing van escBEACOPP vindt plaats op basis van een of meer van de volgende CTCAE toxiciteit criteria:
- Leukopenie graad 4 (< 1.0 × 109/l) langer dan 4 dg
- Thrombopenie graad 4 (< 25 × 109/l)
- Infectie graad 4
- Andere graad 4 toxiciteit, b.v. mucositis
- Uitstel van meer dan 2 week door onvoldoende herstel bloedbeeld
Reductie wordt gegeven volgens het de-escalatie schema volgens onderstaande tabel. NB indien eenmaal een lager dose-level is gegeven, dan niet bij een volgende kuur weer escaleren.
Bleomycine en vincristine worden op dag 8 gegeven onafhankelijk van de bloedwaarden. Bij non-hematologische toxiciteit (koorts, infectie) worden de bleomycine en vincristine op dag 8 weggelaten en na herstel (graad 1) hervat bij de volgende cyclus. Zie voor specifieke vincristine en bleomycine toxiciteit ook de opmerkingen onder algemeen.
| Dosis level De-escalatie |
Cyclofosfamide mg/m2 dag 1 |
Doxorubicine mg/m2 dag 1 |
Etoposide mg/m2 dag 1-3 |
| BEACOPPesc | 1250 | 35 | 200 |
| 3 | 1100 | 35 | 175 |
| 2 | 950 | 35 | 150 |
| 1 | 800 | 35 | 125 |
| BEACOPPbaseline | 650 | 25 | 100 |
Alternatieve schema’s voor patiënten met comorbiditeit of > 70 jaar
- CHOP zie bij DLBCL (link naar CHOP-21)
| EBVP: frequentie: 1 × per 3 weken | |||
| Epirubicine | 70 mg/m2 | i.v. | dag 1 |
| Bleomycine | 10 USP-E (= mg)/m2 | i.v. of i.m | dag 1 |
| Vinblastine | 6 mg/m2 | i.v. | dag 1 |
| Prednisolon | 40 mg/m2 | p.o. | dag 1 t/m 5 |
Modificatie 100% dosering op geleide bloedbeeld
| leuko × 109/l | trombo × 109/l | Epirubicine | Bleomycine Velbe Prednison |
| > 2.5 | > 125 | 100 | 100 |
| 1.5-2.5 | 75-125 | 50 | 100 |
| < 1.5* | < 75* | 0* | 0* |
| * Na 1 week uitstel optimaal doseren volgens bovenstaand schema | |||
| LVPP kuur: frequentie: 1 × per 4 weken | |||
| Chloorambucil | 6 mg/m2 (max 10 mg) | p.o. | dag 1-14 (evt 1-10) |
| Vinblastine | 6 mg/m2 (max 10 mg) | i.v. | dag 1 en 8 |
| Procarbazine | 100 mg/m2 (max 150 mg) | p.o. | dag 1-14 (evt 1-10) |
| Prednisolon | 40 mg/m2 | p.o. | dag 1-14 |
| CEP kuur: 1 × per 3 weken | |||
| CCNU | 80 mg/m2 | p.o. | Dag 1 |
| VP 16 | 100 mg/m2 | p.o. | Dag 1-5 |
| Leukeran | 8 mg/m2 | p.o. | Dag 1-5 |
| Prednisolon | 40 mg/m2 | p.o. | Dag 1-5 |
Literatuurlijst
- Hasenclever, D. en Diehl, V. A prognostic score for advanced Hodgkin’s disease. International Prognostic Factors Project on Advanced Hodgkin’s Disease. N Engl J Med 1998 19;339:1506-14.
- Aleman BM, Raemaekers JM, Tirelli U, et al. Involved field radiotherapy for advanced Hodgkin’s lymphoma. N Engl J Med 2003;348:2396-2406
- Josting, A. C. Rudolph, M. Mapara, et al. Cologne high-dose sequential chemotherapy in relapsed and refractory Hodgkin lymphoma: Results of the German Hodgkin Lymphoma Study Group (GHSG). Annals of Oncology 16 (2005) pp. 116-123
- Evens AM, Cilley J, Ortiz T, Gounder M, Hou N, Rademaker A et al. G-CSF is not necessary to maintain over 99% dose intensity with ABVD in the treatment of Hodgkin lymphoma: low toxicity and excellent outcomes in a 10-year analysis. British Journal of Haematology 2007; 137(6):545-552.
- Nangalia J, Smith H, Wimperis JZ. Isolated neutropenia during ABVD chemotherapy for Hodgkin lymphoma does not require growth factor support. Leuk Lymphoma 2008; 49(8):1530-1536.
- Fermé C, Eghbali H, Meerwaldt JH, et al. Chemotherapy plus involved-field radiation in early stage Hodgkin’s lymphoma. N Engl J Med 2007;357:1916-1927
- Engert A, Haverkamp H, Kobe C, Markova J, et al. Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin’s lymphoma (HD15 trial): a randomised, open-label, phase 3 non-inferiority trial. Lancet 2012;379:1791-1799
- Tarec Christoffer El-Galaly, DÁmore F, Juul Mylan K, et al. Routine Bone Marrow Biopsy Has Little or No Therapeutic Consequence for Positron Emission Tomography/Computed Tomography–Staged Treatment-Naive Patients With Hodgkin Lymphoma, J Clin Oncol 2012; 30:4508-4514
- Younes, A., A.K. Gopal, S.E. Smith, et al. Results of a pivotal phase II study of Brentuximab Vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J Clin Oncol (2012).
- Ansell SM, Lesokhin AM, Borrello I, et al. PD-1 blockade with nivolumab in relapsed or refractory hodgkin’s lymphoma. N Engl J Med. 2015;372(4):311-319.
- Younes A, Santoro A, Shipp M, et al. Nivolumab for classical hodgkin’s lymphoma after failure of both autologous stem-cell transplantation and brentuximab vedotin: A multicentre, multicohort, single-arm phase 2 trial. Lancet Oncol. 2016;17(9):1283-1294.
- Armand P, Shipp MA, Ribrag V, et al. Programmed death-1 blockade with pembrolizumab in patients with classical hodgkin lymphoma after brentuximab vedotin failure. J Clin Oncol. 2016.
- Johnson P, Federico M, Kirkwood A, et al. Adapted treatment guided by interim PET-CT scan in advanced hodgkin’s lymphoma. N Engl J Med. 2016;374(25):2419-2429.
- Moskowitz CH ZP, Fanale MA, et al. Pembrolizumab in relapsed/refractory classical Hodgkin lymphoma: Primary end point analysis of the phase 2 Keynote-087 Study. Blood 2016;128:1107.
- Timmerman JM EA, Younes A, et al. Checkmate 205 update with minimum 12-month follow up: A phase 2 study of nivolumab in patients with relapsed/refractory classical Hodgkin lymphoma. Blood 2016;128:1110
- Andre MPE, Girinsky T, Federico M, et al. Early positron emission tomography response-adapted treatment in stage I and II hodgkin lymphoma: Final results of the randomized EORTC/LYSA/FIL H10 trial. J Clin Oncol. 2017;35(16):1786-1794.
- Skoetz N, Will A, Monsef I, Brillant C, Engert A, von Tresckow B. Comparison of first-line chemotherapy including escalated BEACOPP versus chemotherapy including ABVD for people with early unfavourable or advanced stage hodgkin lymphoma. Cochrane Database Syst Rev. 2017;5:CD007941.




