Introductie
Perifere T-cellymfomen zijn zo divers dat het niet mogelijk is om met één globaal advies voor een beleid te komen (1). Waar mogelijk wordt daarom hieronder per entiteit aangegeven wat het therapie-advies zou zijn. Gezien de moeilijke PA is revisie door een deskundig hematopatholoog altijd vereist. In 10% van de gevallen wordt bij revisie de diagnose bijgesteld (2).
Perifeer T-cellymfoom (PTCL) NOS
Dit type lymfoom gedraagt zich nog het meest als een “gewoon” lymfoom, zoals we van de agressieve B-cellymfomen kennen met voornamelijk klierlokalisaties, hoewel ook hier een deel van de patiënten extranodale lokalisaties zal hebben (huid, beenmerg, tr. digestivus). Het merendeel van de patiënten presenteert zich met uitgebreide ziekte en met B symptomen. De prognose is slecht, met een mediane overleving van 2 jaar na CHO(E)P-therapie.
Angioimmunoblastair T-cellymfoom (AITL)
Dit betreft een maligniteit gekenmerkt door een combinatie van uitgebreide stadium IV ziekte met autoimmuunfenomenen (AIHA, geneesmiddelenallergie, rashes) en lymfomen. De pathologie laat vaak een klonale T-celproliferatie zien, omgeven door polyklonale of oligoklonale B-cellen die frequent EBV-positief zijn. Het verraderlijke van deze patiëntengroep is dat het ogenschijnlijk aanvankelijk uitstekend gaat, met een vlotte complete remissie op CHOP-therapie. Helaas recidiveert een aanzienlijk deel van de patiënten, resulterend in uiteindelijk een slechte prognose. Een deel van de patiënten is bovendien at risk voor het ontwikkelen van een EBV-positief agressief B-cellymfoom. Vandaar dat het extra belangrijk is om in het geval van een recidief histologische bevestiging na te streven.
Anaplastic large cell lymphoma (ALCL), ALK-positief
Dit type lymfoom is de gunstige uitzondering te midden van alle andere T-celmaligniteiten, gezien het feit dat de prognose bij het merendeel van de patiënten goed is. Het is typisch een lymfoom bij jongvolwassenen. De entiteit is gekenmerkt door een reciproke translocatie waarbij in ieder geval breuken op chromosoom 2p23 zijn betrokken. Het vaakst wordt de t(2;5) aangetroffen, waarbij overexpressie ontstaat van het ALK-gen. Ook patiënten met een hoge IPI-score en hoog stadium bij de start hebben een grote geneeskans, met een langetermijnplateau in de overlevingscurve op het niveau van 70-80% (3).
Anaplastic large cell lymphoma (ALCL), ALK-negatief
Morfologisch is deze entiteit niet te onderscheiden van de bovenstaande, behalve het ontbreken van ALK-eiwitexpressie. De leeftijdscategorie is ouder met een piek tussen de 40 en 65 jaar. Het merendeel van de patiënten heeft stadium IV ziekte bij presentatie. De prognose van deze subset is helaas veel slechter dan van de ALK-positieve variant, en lijkt meer op de slechte overlevingscurves van T-cellymfomen. Zie review Ferreri et al., 2013 (4).
Extranodaal NK/T-cellymfoom, nasale type
Aanvankelijk werd dit beschouwd als necrotiserende vasculitis, totdat duidelijk werd dat het zogenaamde angio-invasieve (vandaar de vaatnecrose) infiltraat veroorzaakt werd door klonale EBV-positieve NK- of T-cellen. In Nederland is het een zeldzame ziekte met 5 tot 10 nieuwe casussen per jaar. In Azië, Midden en Zuid-Amerika is tot 15% van de nieuw gediagnostiseerde lymfomen een NK/T-cellymfoom. De voorkeurslokalisaties zijn de nasofarynx, de sinussen, tonsillen, de ring van Waldeyer en orofarynx. Ongeveer 70-90% van de patiënten presenteren zich met een stadium I- of II-lymfoom. Gevorderde stadia komen vaak voor in long, gastro-intestinaal en cutaan. Bij diagnose zijn een PET/CT, MRI van de nasopharynx en plasma-EBV belangrijk. Dit laatste is ook in de follow-up en belangrijke tumormarker.
Enteropathy type T-cell lymphoma (EATL)
De klassieke presentatie is die van een patiënt reeds bekend met coeliakie bij wie het ziektebeeld refractair wordt met steeds meer afwijkende T-cellen in de ontstoken, ulcererende darm totdat het beeld evolueert tot een overt lymfoom. Sommigen beschouwen refractaire coeliakie reeds als een T-NHL. Maar een EATL kan ook zonder coeliakie-voorgeschiedenis manifest worden. Vaak blijkt dan in tweede instantie ook coeliakie aanwezig te zijn.
Hepatosplenic gamma/delta T-cell lymphoma
Dit is een uitermate zeldzaam, zeer verraderlijk lymfoom, meestal bij jonge patiënten, zich presenterend met hepatosplenomegalie, pancytopenie (overigens initieel meestal nog niet met beenmerginfiltratie) en uitgebreide B-symptomen. Het wordt wel eens gezien na infliximab gegeven in het kader van de ziekte van Crohn. De ziekte gedraagt zich erg agressief. Na een aanvankelijke respons treden bij de meerderheid recidieven op met een uiteindelijke overleving van minder dan twee jaar.
Primary cutaneous T Cell lymphoma, type gamma/delta
Erg zeldzaam, multipele cutane of juist subcutane nodi met of zonder necrose bestaande uit gamma/delta T-cellen. Gaat vaak gepaard met B-symptomen en een hemofagocytair syndroom. Eerste uiting kan een hemofagocytair syndroom zijn met slechts een minimale tumor. Verraderlijk beeld met een zeer slechte prognose door primaire resistentie tegen chemotherapie (5).
Primary subcutanous T Cell lymphoma, type alfa/beta
Het subcutaneous panniculitis-like T-cellymfoom, alfa-beta type wordt nu als een veel indolenter type lymfoom beschouwd waarvoor intensieve chemotherapie meestal niet geïndiceerd is. Een deel van de patiënten reageert uitstekend op prednison (start met 30-40 mg), waarna de dosis in de loop van 3-6 maanden afgebouwd kan worden. Goed monitoren op recidief, dan wel de ontwikkeling van een hemofagocytair syndroom is belangrijk (5).
Diagnostiek
Anamnese
- Inventarisatie duur en aard van klachten inclusief B-symptomen, huidmanifestaties, allergieën en darmklachten.
- Beoordeling pre-existente performance inclusief beperkende klachten ten gevolge van orgaandysfunctie en met inschatting van ziekte-gerelateerd conditieverlies
- Mentale fitheid
- Psychosociale omstandigheden
Lichamelijk onderzoek; WHO/ECOG/Frailty
Algemeen lichamelijk onderzoek met speciale aandacht voor
- WHO performance status
- Hart en longen
- Lymfeklieren incl. tongtonsillen
- Hepatosplenomegalie
- Huidafwijkingen
Laboratoriumonderzoek
- Volledig bloedbeeld inclusief leukocytendifferentiatie, kreatinine, leverenzymen, glucose, albumine, LDH
- Serologie: Hepatitis B, C en HIV
- Indien van toepassing: zwangerschapstest
- Op indicatie: ferritine (hematofagocytair syndroom!), EBV PCR, hapto, Coombstest
Aanvullend onderzoek
- Beeldvorming: Bij diagnose: FDG-PET/CT-scan met een CT-scan met contrast van hals, thorax, abdomen.
- Pathologie: bij voorkeur een volledige klier of een ruim excisie- of incisiebiopt van een betrokken nodale of extranodale tumorlokalisatie. Bij grote uitzondering (immers moeilijke PA) kan een dikkenaaldbiopt (14 G) volstaan. Cytologisch onderzoek is onvoldoende voor het stellen van de diagnose.
- TTE: op indicatie (anthracyclines).
- Beenmerg: tenminste morfologie en PA.
- Bij extranodaal NK/T-cellymfoom: MRI nasopharynx.
Risicoclassificatie en Prognose
In het algemeen geldt dat T-NHL een slechte prognose heeft, afhankelijk van het subtype. De IPI-score heeft ook bij het PTCL-NOS, ALCL en AITL een voorspellende waarde, met een 5-jaarsoverleving van 70-80% voor laag-risicopatiënten tot 10-15% voor hoog-risicopatiënten.
Behandeling (+hyperlink)
Filter trials en protocollen voor dit ziektebeeldEerste lijn
Stadium I
> 18 jaar: alle T- cellymfomen (behalve EATL en NK/T-cellymfoom): 3 CHOEP + RT
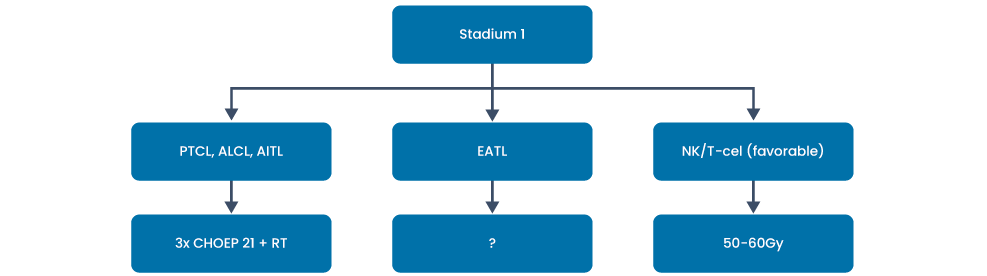
Toelichting:
Data omtrent optimale behandeling van stadium 1 PTCL is zeer beperkt. In de analyse van Meeuwes et al. heeft gecombineerde behandeling met CHO(E)P gevolgd door radiotherapie voor patiënten met een stadium I ALCL, AITL en PTCL-NOS een 5-jaarsoverleving van 58%. De 5-jaarsoverleving voor patiënten met een EATL is echter uitermate slecht (15%).
Stadium II-IV lymfomen (voor subgroepen zie hieronder):
>18 jaar: ALK+ ALCL: 6x CHOEP, dan wel 6x BV-CHP
<65 jaar/fit: alle T-cellymfomen (behalve ALK+ ALCL en NK/T cellymfoom): 6 × CHOP21 (5) gevolgd door autologe stamceltransplantatie na BEAM conditionering (6, 7).
>65 jaar/niet fit: alle T-cellymfomen (behalve ALK-positief ALCL en NK/T cellymfoom): 6 × CHOP21 (3).
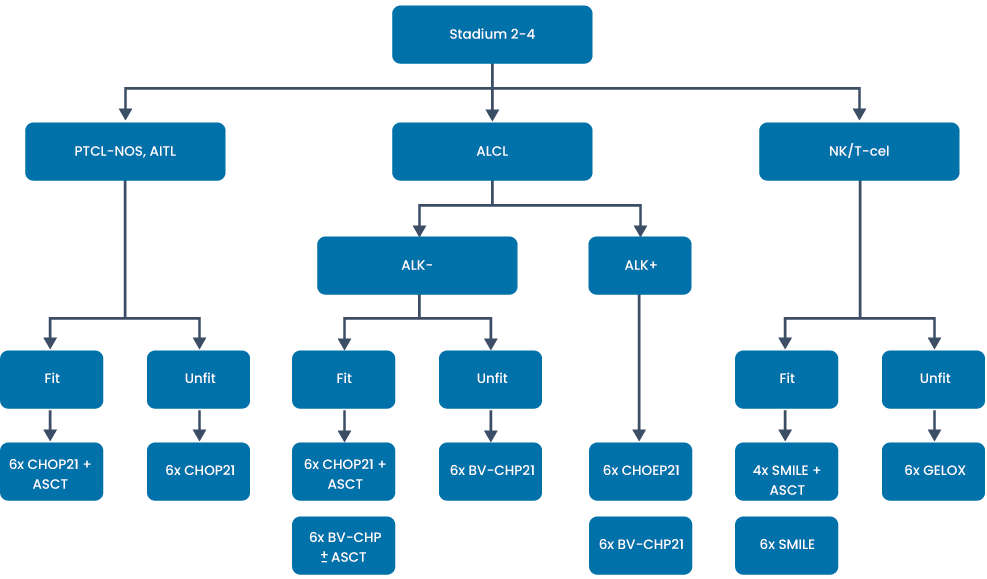
Toelichting:
Vanaf 2008 is er in Nederland op basis van Duitse fase 2-studies etoposide toegevoegd aan CHOP bij jongere patiënten. Een recente grote analyse van de Nederlandse data laten alleen een positief effect zien van CHOEP bij ALK+ ALCL.
Er zijn geen gerandomiseerde fase 3-studies naar de benefit van ASCT. De 2 grootste fase 2 studies laten t.o.v. historische cohorten een verbeterde 3-jaarsoverleving zien waarbij de ALK-ALCL-patiënten de beste uitkomst hebben (5, 6). In de analyse van de Nederlandse populatie zien we ook daar een overlevingsvoordeel (zij het gering) voor ASCT. Dit effect blijft in stand voor patiënten die een complete remissie bereiken.
Eind 2018 zijn de resultaten gepubliceerd van de fase 3-studie van brentuximab vedotin-CHP versus CHOP in CD30+ T-NHL (8). De studiepopulatie betrof voor 72% patiënten met een ALCL (zowel ALK-positief als ALK-negatief). De mediane PFS was 48 versus 21 maanden ten voordele van B-CHP. In de trial kregen patiënten geen etoposide en werd bij een klein deel van de patiënten een ASCT verricht. 28% van de patiënten had een ander T-NHL subtype.
Perifeer T-cellymfoom (PTCL) NOS
Therapie: zie flowdiagram.
Therapie buiten trialverband:
< 65 jaar: 6 × CHOP21 (3), gevolgd door autologe stamceltransplantatie na conditionering met BEAM (6, 7).
> 65 jaar: 6 × CHOP-21 (3).
Angioimmunoblastair T-cellymfoom (AITL)
Therapie: zie flowdiagram.
Op basis van de analyse van de Nederlandse data blijkt er geen voordeel te bestaan van het toevoegen van rituximab.
Anaplastic large cell lymphoma (ALCL), ALK-positief
Therapie: zie flowdiagram.
Therapie: 6 CHOEP-kuren. In deze gunstige subgroep lijkt het toevoegen van etoposide aan CHOP meerwaarde te hebben.
Anaplastic large cell lymphoma (ALCL), ALK-negatief
Therapie: zie flowdiagram.
Bij ALK-negatief ALCL is behandeling met CHOP gevolgd door ASCT jaren de standaard geweest in Nederland. Brentuximab-vedotin CHP heeft weliswaar een betere PFS en OS dan CHOP, maar het merendeel van de patiënten in de studie heeft geen ASCT gehad. Een subgroupanalyse van de studie leek ook voor patiënten behandeld met BV-CHP gevolgd door een ASCT een voordeel te geven, maar daar was de studie formeel niet voor gepowerd. BV-CHP kan overwogen worden voor hoog-risicopatiënten.
Er zijn drie entiteiten die apart benaderd moeten worden:
- Lymphomatoide papulose: een maanden- tot jarenlang bestaand huidbeeld met kleine papels die komen en gaan, waarbij een biopt het beeld laat zien van een agressief ALCL. Desondanks is het een beeld dat geen therapie behoeft, met een uitstekende prognose. Twintig procent van de patiënten ontwikkelt in de loop van het een ander non-Hodgkin lymfoom.
- Primair cutaan CD30+lymfoom: solitaire of gelokaliseerde groepjes van papels dan wel grotere huidtumoren, soms met ulceratie. Moet onderscheiden worden van een transformatie vanuit mycosis fungoides, en ook onderscheiden worden van een systemisch ALCL. Primair cutaan CD30+lymfoom heeft een uitstekende prognose (10 jaar DFS 90%). Radiotherapie is meestal voldoende.
- ALCL in relatie tot mamma-implantaten. Een nieuwe combinatie van effusie en seroom in relatie tot implantaten die steeds vaker herkend wordt. De prognose lijkt veel beter dan die van een primair systemisch ALCL. In geval van beperkte ziekte kan worden volstaan met chirurgische resectie van het transplantaat. In geval van een stadium II-IV ziekte dient chirurgie gecombineerd te worden met adjuvante chemotherapie (10).
Extranodale NK/T-cellymfoom, nasale type
Therapie: Belangrijk is om bij een stadium I ziekte onderscheid te maken tussen een hoog en laag risico conform de studie van Yang et al (14). Hoog-risicofactoren zijn leeftijd > 60 jaar, verhoogd LDH, ECOG ≥ 2, tumorinvasie in omliggende structuren. Bij het ontbreken van één van de risicofactoren bestaat de behandeling uit 50-56 Gy radiotherapie. Bij aanwezigheid van risicofactoren of een stadium II ziekte bestaat de behandeling uit 2 SMILE-kuren (Steroid-MTX-Ifosfamide-L-asparaginase-Etoposide), 50-56 Gy radiotherapie en nogmaals 2 SMILE-kuren. Bij een stadium III/IV ziekte gaat de voorkeur uit naar 3 tot 4 SMILE-kuren gevolgd door een autologe stamceltransplantatie (11). Niet-fitte patiënten kunnen behandeld worden met GELOX.
Enteropathy type T-cell lymphoma (EATL)
Dit type patiënten is meestal te slecht om nog intensief behandeld te worden. Ze zijn vaak ernstig vermagerd en ondervoed met een slechte performance, waarbij CHOP- of CHOEP-chemotherapie resulteert in veel en ernstige complicaties. Er is gelukkig een subgroep patiënten die zich anders presenteert: een acute buik met darmtumor, uitgaande van de dunne darm, waarbij vervolgens bij toeval coeliakie geconstateerd wordt. Deze groep is na de chirurgie over het algemeen in een veel betere conditie en laat zich ook beter behandelen. Radicale chirurgie verbetert de prognose bovendien. Mochten de patiënten de inductiebehandeling goed doorstaan hebben, dan valt bij de jongere groep (< 60-65 jaar) auto-SCT te overwegen. Na een initiële respons zal het lymfoom overigens meestal recidiveren, en dan is de conditie van de patiënt vaak te slecht om nog hoge-dosischemotherapie met stamceltransplantatie te kunnen ondergaan. Aangezien circa 50% van EATL’s CD30 tot expressie brengt is er zeker ook een plaats voor Brentuximab-Vedotin. Zie verder het uitstekende review van Di Sabatino (12).
Hepatosplenic gamma/delta T-cell lymphoma
Therapie: Zie het mooie review van Ferreri et al., 2012 (13). Een schema bestaande uit DHAP, evt. afgewisseld met CHOEP lijkt het beste. Indien een remissie bereikt wordt is een auto-SCT of zelfs een allo-SCT te overwegen.
Primary cutaneous T-cell lymphoma, type gamma/delta
Behandeling is conform perifeer T-cellymfoom NOS.
Primary subcutanous T-cell lymphoma, type alfa/beta
Dit wordt beschouwd als een indolenter lymfoom dat uitstekend reageert op prednison (start met 30-40 mg), waarna de dosis in de loop van 3-6 maanden afgebouwd kan worden. Goed monitoren op recidief, dan wel de ontwikkeling van een hemofagocytair syndroom (5).
Recidief
Als < 65 jaar/fit en nog geen autologe stamceltransplantatie gehad: DHAP/VIM/DHAP gevolgd door BEAM en autologe stamceltransplantatie.
Ziektespecifiek:
Voor CD30+ ALCL: Bij recidief behandeling met brentuximab-vedotin, waarmee in 66% een complete remissie bereikt kan worden (14). Voor patiënten die een CR behalen (al dan niet in combinatie met een consoliderende ASCT) kan een langdurig(e) remissie/plateau worden bereikt met een 3-jaarsoverleving van 50-60%.
Voor andere CD30+ lymfomen (sommige PTCL’s, 50% van de EATL’s) valt het ook te overwegen brentuximab toe te voegen .
NK/T: Bij een recidief gaat indien de patiënt nog geen SMILE-kuur heeft gehad de voorkeur uit naar 3 SMILE-kuren, gevolgd door een allogene stamceltransplantatie met 12 GY TBI en post-Tx cyclofosfamide als conditionering. Indien de patiënt al wel SMILE-kuren heeft gehad, kan inductie met GELOX (Gemcitamine, Oxaliplatin en L-asapraginase) gebruikt worden, gevolgd door een allogene stamceltransplantatie. Hernieuwde behandeling met een asparaginase-bevattende therapie is alleen zinvol indien voorgaande behandeling minimaal 6 maanden geleden is.
Overigens zijn er ook goede resultaten beschreven met PD1/PDL-1 inhibitie, echter is dit niet in Nederland regulier geregistreerd. Mogelijk dat behandeling in studie wel mogelijk is.
Voor meer achtergrond en informatie over de behandeling verwijzen we u naar de artikelen van Van Doesum et al. NTVH dec 2019 (11) en Hemasphere 2021, Yamaguchi et al. Blood 2018 (15) en Tse et al. Blood 2013 (16).
Literatuurlijst
- Swerdlow SH, Campo E, Harris NL et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon: 2017.
- Moskowitz AJ, Lunning MA, Horwitz SM. How I treat peripheral T-cell lymphomas. Blood. 2014;123:2636-2644
- Schmitz N, Trumper L, Ziepert M et al. Treatment and prognosis of mature T-cell and NK-cell lymphoma: an analysis of patients with T-cell lymphoma treated in studies of the German High-Grade Non-Hodgkin’s Lymphoma Study Group (DSHNHL). Blood 2010;116:3418-3425.
- Ferreri AJ, Govi S, Pileri SA, Savage KJ. Anaplastic large cell lymphoma, ALK-negative. Crit Rev Oncol Hematol 2013;85:206-215.
- Willemze R, Jansen PM, Cerroni L et al. Subcutaneous panniculitis-like T-cell lymphoma: definition, classification, and prognostic factors: an EORTC Cutaneous Lymphoma Group Study of 83 cases. Blood 2008;111:838-845.
- D’Amore F, Relander T, Lauritzsen GF et al. Upfront Autologuos Stem-Cell Transplantation in Peripheral T-Cell Lymphoma: NLG-T-01. J Clin Oncol 2012;30:3093-3099.
- Reimer P, Rudiger T, Geissinger E et al. Autologous stem-cell transplantation as first-line therapy in peripheral T-cell lymphomas: results of a prospective multicenter study. J Clin Oncol 2009;27(1):106-113.
- Horwitz S, O’Connor OA, Pro B, et al. Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial. Lancet 2019: 393:229-240
- Cederleuf H, Pedersen MB, Jerkeman M, et al. The addition of etoposide to CHOP is associated with improved outcome in ALK+ adult anaplastic large cell lymphoma: A Nordic Lymphoma Group study. BJH 2017; 178: 739-746
- Mehta-Shah N, Clemens MW, Horwitz SM. How I treat breast implant-associated anaplastic large cell lymphoma. Blood 2018 Nov 1;132(18):1889-1898
- Van Doesum J.A. et al. Extranodaal NK/T-cellymfoom nasal type: diagnostiek en behandeling. Ned Tijdschr Hematol 2019;16:382-9
- Sabatino A., Biagi F, Gobbi PG, Corazza GR. How I treat enteropathy-associated T-cell lymphoma. Blood 2012;119:2458-2468.
- Ferreri AJ, Govi S, Pileri SA. Hepatosplenic gamma-delta T-cell lymphoma. Crit Rev Oncol/Hematol 2012;83:283
- Pro B, Advani R, Brice P, et al. Five-year results of brentuximab vedotin in patients with relapsed or refractory systemic anaplastic large cell lymphoma. Blood 2017 130:2709-2717
- Yamaguchi M, et Al. Advances in treatment of extranodal NK/T-cell lymphoma, nasal type. Blood 2018;131:2528-40
- Tse E, et al. How I treat NK/T-cell lymphomas. Blood 2013;121:4997-5005




