
Dia 1
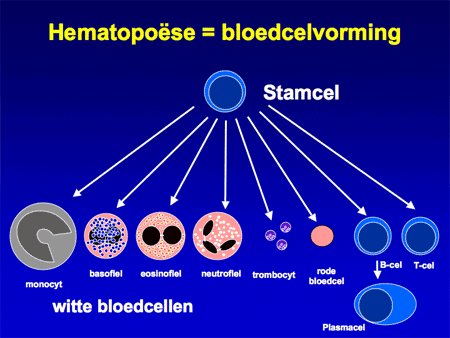
Acute lymfatische leukemie (ALL) is een onderdeel van de acute leukemieën. Onder acute leukemie (ook wel bloedkanker genoemd) wordt een levensbedreigend ziektebeeld verstaan waarbij in korte tijd (dagen tot weken) een snelle woekering van kwaadaardige leukemiecellen (blasten) de plaats inneemt van de normale bloedaanmaak. De normale bloedaanmaak speelt zich af in het beenmerg (zie ook Beenmergonderzoek) (dia 2 en 3). Daarbij worden de verschillende celsoorten aangemaakt, zoals de rode cellen (nodig voor zuurstoftransport; een tekort geeft bloedarmoede), witte cellen (leukocyten genaamd; er zijn veel verschillende soorten en ze zijn nodig voor de afweer tegen bacteriën, virussen en andere infectiebronnen) en bloedplaatjes (trombocyten genaamd, nodig voor de bloedstolling).
Dia 2
Dia 3
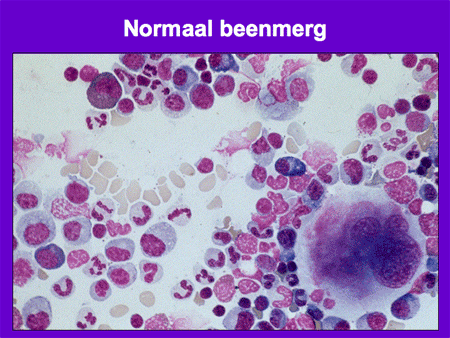
Wanneer normaal beenmerg, na een beenmergpunctie verkregen, onder de microscoop bekeken wordt, is er een heel divers beeld te zien van alle verschillende celsoorten (dia 3). In het geval van acute leukemie zijn vrijwel alle normale beenmergelementen vervangen door de blasten (dia 4). Het ziektebeeld leukemie kenmerkt zich dan ook vooral door het feit dat er enerzijds een teveel is aan leukemiecellen en anderzijds een tekort aan de normale bloedelementen (dia 5).
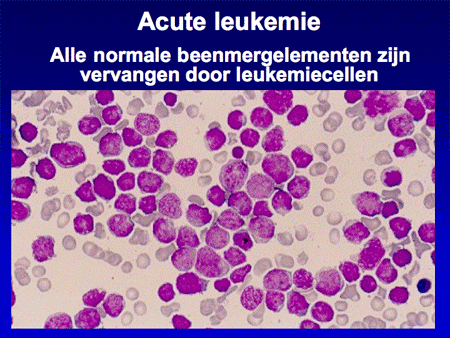
Dia 4. Bij acute leukemie zijn vrijwel alle normale beenmergelementen vervangen door leukemiecellen

Dia 5
Hoe ontstaat acute leukemie en hoe vaak komt het voor?
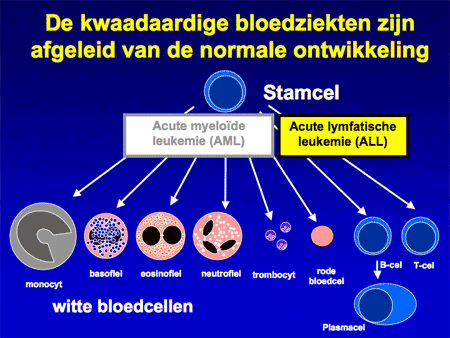
Aangenomen wordt dat de kwaadaardige cellen bij acute leukemie ontstaan op het niveau van de vroegste ontwikkeling van de normale bloedcellen, de stamcellen (zie dia 6). Ergens tijdens de deling van die bloedstamcellen gaat iets mis, waardoor de cellen harder gaan delen en bovendien ook niet meer uitrijpen tot normale bloedcellen (dia 7).
Het is niet bekend hoe acute lymfatische leukemie kan ontstaan. Van andere vormen van acute leukemie, zoals acute myeloïde leukemie (AML) is iets meer bekend, maar ook daarvoor geldt dat de grote meerderheid ‘zomaar’ ontstaat, zonder dat de reden bekend is. In het zeldzame geval dat er wel een verklaring lijkt te zijn, gaat het om oorzaken als straling of bepaald medicamentengebruik. AML kan ontstaan na straling, zoals gezien is na de atoombommen in Japan. Ook zijn er bepaalde celdodende medicijnen (gebruikt als antikankerbehandeling, chemotherapie) die op hun beurt weer acute leukemie kunnen doen ontstaan.
Acute leukemie is erg zeldzaam en wordt per jaar bij ongeveer 4 patiënten per 100.000 inwoners in Nederland gezien. Van de twee verschillende soorten – acute myeloïde (AML) en acute lymfatische leukemie (ALL) – komt ALL vooral bij kinderen voor, hoewel ALL net zo goed ook bij volwassenen gezien wordt. AML is veel meer een ziekte van volwassenen.
Dia 6
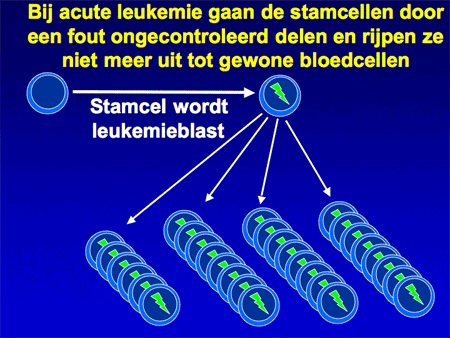
Dia 7
Hoe wordt de diagnose gesteld?
Patiënten met acute leukemie hebben vrijwel altijd klachten en symptomen die veroorzaakt zijn door het teveel aan leukemiecellen en het tekort aan normale cellen. Door de bloedarmoede kan algemene zwakte en bleekheid met onverklaarbare, toenemende vermoeidheid gezien worden. Door het tekort aan witte cellen kunnen veelvuldig terugkerende kleine infecties en koorts ontstaan. Door het tekort aan bloedplaatjes ontstaan gemakkelijk blauwe plekken of bloedingen, zoals neusbloedingen, kleine huidbloedingen (kleine rode stipjes op het lichaam) of tandvleesbloedingen (bijvoorbeeld bij het tandenpoetsen).
Bloed- en beenmergonderzoek is voldoende om de diagnose te stellen. Aan dit onderzoek zijn wel voorwaarden verbonden. Het materiaal moet op een speciale manier verwerkt worden om alle specifieke kleuringen, waaronder ook flowcytometrie (zie flowcytometrie), op de cellen te kunnen verrichten en bij voorkeur ook chromosomenonderzoek te kunnen doen. Deze extra technieken zijn nodig om de leukemie beter te kunnen classificeren. Bovendien is het hiermee mogelijk een betere schatting te maken van de prognose. Sommige leukemieën zijn – voorspelbaar – beter te behandelen dan andere. Vaak betekent dit daarom dat het onderzoek overgedaan moet worden als een patiënt verwezen wordt naar een centrum voor behandeling.
Bij ALL wordt onderscheid gemaakt tussen twee grote groepen: voorloper B-cel ALL en voorloper T-cel ALL (dia 9). Bij de T-ALL is vaak sprake van lymfkliervergroting, waaronder ook de lymfklieren tussen de longen en het hart (mediastinum). Soms is het nodig dit gebied te bestralen als patiënten het door de lymfkliervergroting benauwd hebben. Na de bestraling verdwijnen de klachten onmiddellijk. Behalve deze verschillen is de behandeling van beide typen hetzelfde.

Dia 8
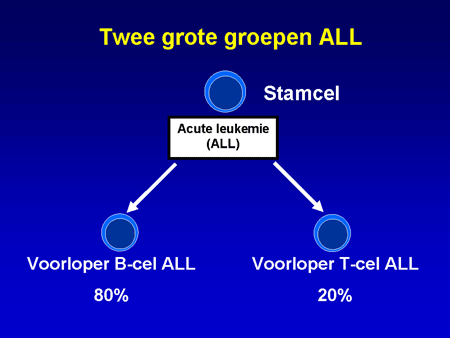
Dia 9
Therapie ALL
Allereerst volgt hier een algemene uitleg. Daarna wordt de specifieke therapie bij acute lymfatische leukemie besproken.
Behandeling van acute leukemie
Om de kwaadaardige cellen kwijt te raken moeten patiënten behandeld worden met hoge doses celdodende medicijnen (chemotherapie). Deze medicijnen zullen de leukemiecellen doden, maar tijdelijk ook de gewone bloedcellen in het beenmerg. Dit komt omdat leukemiecellen immers erg lijken op normale bloedcellen en de celdodende medicijnen het onderscheid niet goed kunnen zien. Gelukkig zijn normale bloedcellen meestal sterker dan leukemiecellen. Het gevolg is dat normale bloedcellen vanuit de enkele achtergebleven gezonde stamcellen weer zullen uitrijpen, terwijl de leukemiecellen hopelijk zijn uitgeschakeld. Er moet echter – per behandelingsperiode, en er zijn er meerdere! – wel steeds een gevaarlijke periode overbrugd worden van enkele weken, waarin de bloedcelaanmaak stilligt en de patiënt geen eigen rode cellen, witte cellen en bloedplaatjes aanmaakt. Acute-leukemiepatiënten hebben bij de start al een slechte weerstand door de aantasting van hun normale bloedcelaanmaak. Door de chemotherapie zal deze weerstand dus nog verder verslechteren. Voor een dergelijke behandeling met chemotherapie moeten patiënten dan ook opgenomen worden in het ziekenhuis, bij voorkeur in een centrum met een beschermde afdeling dat in staat is dit soort zware therapie te geven. In het UMCG is de gehele verpleegafdeling E2VA beschermd, inclusief de gangen en vierpersoonskamers. Dit betekent dat het niet altijd nodig is een patiënt met acute leukemie op een eenpersoonskamer te verplegen. Omdat chemotherapie schadelijk kan zijn voor gezonde personen, zoals voor het verpleegkundig personeel kan gelden, worden op de afdeling regels voor het omgaan met besmet materiaal gehanteerd om hen zo veel mogelijk te beschermen.
Voordat gestart kan worden met de behandeling, wordt eerst onderzocht of een patiënt nog infecties bij zich draagt die tijdens de behandeling een probleem zouden kunnen geven. Het gaat dan om infecties vanuit de neus, keel en longen en vooral om infecties vanuit het gebit. In het UMCG worden de patiënten daarom uitgebreid onderzocht door de keel-neus-oren (KNO)-arts en door de kaakchirurg/tandarts en worden zij ook tijdens de behandeling begeleid door de mondhygiënist(e). Heel vaak blijkt het helaas noodzakelijk enkele gebitselementen te verwijderen, omdat deze anders tijdens de behandeling met chemotherapie problemen zouden kunnen geven.
Behalve de chemotherapie worden beschermende antibiotica gegeven om de weerstand in het lichaam, vooral in de mond en in de darmen, te verhogen. Deze antibioticacombinatie wordt selectieve darmdecontaminatie genoemd. Het tekort aan rode cellen en bloedplaatjes (trombocyten) wordt opgevangen door regelmatig bloedtransfusies te geven.
Door de chemotherapie kan misselijkheid ontstaan en kunnen de slijmvliezen erg geïrriteerd raken. Eten is dan moeilijk, terwijl het extra belangrijk is dat de voedingstoestand van een patiënt op peil blijft. Er zijn rond de voeding een aantal adviezen, zowel over de kwaliteit ervan als de voedingswaarde. Samen met de diëtist(e) wordt zonodig dagelijks bekeken hoe de voedingstoestand van een patiënt zo goed mogelijk op peil blijft. Er worden daarbij richtlijnen gehanteerd waarbij bepaalde voedingsmiddelen minder gewenst zijn, omdat ze bijvoorbeeld voedselinfecties kunnen veroorzaken bij patiënten met verminderde weerstand. Als het niet goed lukt om voldoende voeding naar binnen te krijgen, wordt overgegaan op voeding via de bloedbaan (zogenaamde TPN, totale parenterale nutritie). Om deze voeding veilig te kunnen toedienen is het nodig over een goede toegang tot de bloedbaan te beschikken. Bij voorkeur wordt hiervoor een speciaal aangelegd infuus (centraal veneuze katheter) gebruikt, dat ingebracht wordt onder het sleutelbeen. Dit infuus wordt – voordat met de chemotherapie gestart wordt – op de afdeling ingebracht door een van de hematologen onder zo steriel mogelijke omstandigheden. Daarna wordt de insteekopening van het infuus regelmatig door de verpleegkundigen schoongemaakt en goed gecontroleerd op het ontstaan van infecties. Helaas raakt ook een dergelijk infuus nog wel eens besmet en dan zal het weer verwijderd moeten worden.
Patiënten kunnen zich moe en aangeslagen voelen door de behandeling. Desalniettemin is het van het grootste belang dat de conditie zo goed mogelijk blijft. Hoe meer een patiënt uit bed is, hoe beter. Door middel van een hometrainer (fiets of loopband) is het mogelijk de conditie zo goed en kwaad als het kan op peil te houden. Daarnaast is het ook belangrijk dat de geestelijke conditie goed blijft. De krant lezen, het journaal volgen en contact onderhouden met de omgeving (er zijn op de afdeling computerlaptops met internetaansluiting) wordt van harte gestimuleerd. Een overzicht van zo’n kuur met alle voorzorgsmaatregelen is te zien op dia 11.
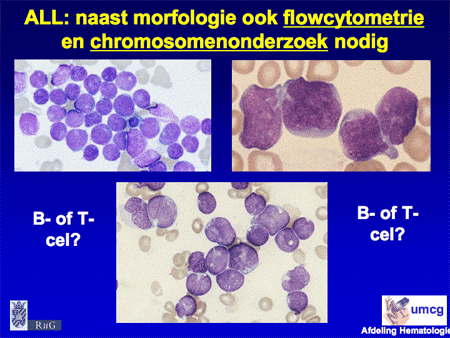
Dia 10. Bij ALL is naast morfologie ook flowcytometrie en chromosomenonderzoek nodig

Dia 11
Specifieke behandeling van acute lymfatische leukemie
De behandeling van ALL is anders dan die van AML (dia 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22). De behandeling duurt lang, omdat er na de behandelingen in het ziekenhuis nog een anderhalf tot twee jaar durende poliklinische onderhoudsbehandeling moet plaatsvinden. Daarnaast moeten ALL-patiënten een extra behandeling van het zenuwstelsel krijgen, omdat ALL erg snel uitzaait richting de hersenvliezen. Deze zenuwstelselbehandeling gaat via ruggenprikken (liquorpuncties). Als deze prikken een probleem vormen, wordt er als alternatief een klein prikkamertje (Ommaya-reservoir) ingebracht onder de schedelhuid, waardoor heel gemakkelijk medicijnen toegediend kunnen worden.
Er wordt bij de behandeling onderscheid gemaakt tussen jonge (jonger dan 40 jaar) en oudere patiënten. Dat heeft te maken met het feit dat niemand begrijpt waarom het bij jongeren met ALL over het algemeen beter gaat dan bij ouderen. Bij kinderen is dat het duidelijkst. Kinderen met ALL hebben een hoge geneeskans als ze de behandeling goed doorstaan. Verreweg de meerderheid zal uiteindelijk genezen, dat wil zeggen: de ziekte nooit meer terugkrijgen. Bij volwassenen gaat het echter minder goed, wat betekent dat de kans dat na behandeling de ziekte terugkomt groter is. De grote vraag is hoe dit komt. Er zijn twee antwoorden mogelijk:
- kinder-ALL is een andere (minder agressieve) ziekte dan volwassen ALL; of
- kinderen worden beter behandeld dan volwassenen.
Er is tot nu toe een groot verschil tussen de behandeling van kinderen en volwassenen. Kinderen krijgen over het algemeen een veel intensiever chemotherapieschema in een veel hogere dosis dan gebruikelijk is bij volwassenen. Kinderen kunnen ook meer verdragen, hun organen zijn jonger en hun weerstand en herstelvermogen zijn meestal veel veerkrachtiger dan bij ouderen.
HOVON-studies
Er valt nog veel te verbeteren aan de behandeling van ALL. Verbeteringen kunnen alleen plaatsvinden als patiënten binnen zogenaamde studies behandeld worden. Een patiënt krijgt in een bepaalde studie een vooraf afgesproken behandeling en wordt nauwkeurig gevolgd volgens protocol. Vanzelfsprekend gebeurt dit alleen als de patiënt hier – na uitgebreide (schriftelijke) informatie – toestemming voor geeft. Door alle gegevens zorgvuldig te verzamelen kan bijvoorbeeld onderzocht worden of een nieuw schema beter is dan een tot nu toe gebruikt standaardschema. Op deze wijze kan de behandeling stap voor stap verbeterd worden zodat meer ALL-patiënten kunnen genezen. In Nederland vinden de meeste studies plaats binnen HOVON-verband.
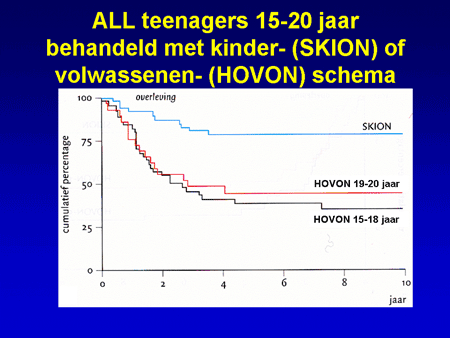
Er zijn uit eerdere studies inmiddels aanwijzingen dat het de moeite waard is te proberen de chemotherapie voor ALL te verzwaren. Deze aanwijzingen komen van een vergelijkend onderzoek tussen twee behandelingen bij tieners. Omdat tieners (jongeren tussen 15 en 20 jaar) soms bij een kinderarts en soms bij een internist-hematoloog terechtkomen, zijn de gegevens onderzocht van een aantal van deze jongeren. Het bleek dat de jongeren behandeld met het kinderschema een betere uitkomst hadden dan diegenen die door de internist-hematoloog behandeld waren (zie hieronder). Dit gaf de doorslag om nu bij de behandeling in te zetten op zo intensief mogelijke therapie bij “jongeren” (tot de leeftijd van 40 jaar), en bij 40-plussers ook in te zetten op zo intensief mogelijke behandeling, maar waarbij dan meer rekening gehouden wordt met de leeftijd wanneer patiënten ouder zijn. Bij deze behandelschema’s wordt tevens onderzocht in hoeverre nieuwe middelen, zoals bijvoorbeeld het middel clofarabine, een extra betekenis kunnen hebben. Wanneer vooraf wordt ingeschat dat de kans op blijvende genezing na alleen chemotherapie niet groot is, wordt patiënten na de klinische kuren in plaats van een onderhoudsbehandeling van 2 jaar, een stamceltransplantatie aangeboden gebruikmakend van stamcellen van een gezonde donor (broer of zuster, of een donor uit de vrijwillige donorbank).
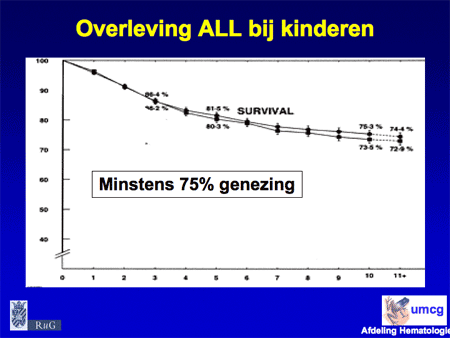
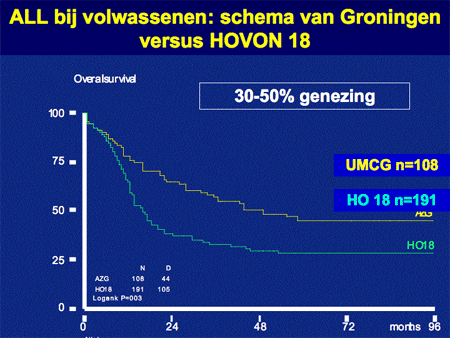
Voor patiënten die niet in officiële HOVON studies kunnen participeren hanteren we een Groninger schema, ontwikkeld door Dr. Daenen, één van onze hematologen. Het verschil in het Groninger schema met dat van de rest van Nederland is de start van de eerste kuur (een soort voorafkuur [pre-inductiekuur]), met aan het eind van de kuren nog een nabehandeling in de polikliniek van twee jaar. In het verleden is het Groninger schema vergeleken met de vroegere gebruikelijke HOVON behandeling. Het bleek dat de uitkomsten in ieder geval gunstiger ware, qua overleving (zie de laatste dia).

Dia 12

Dia 13

Dia 14
Dia 15

Dia 16

Dia 17

Dia 18

Dia 19
Dia 20

Dia 21
Dia 22
Hulp en ondersteuning tijdens en na therapie
Patiëntenvereniging
Veel patiënten hebben baat bij contact met de patiëntenvereniging, welke zich bevindt binnen de overkoepelende patientenvereniging HEMATON voor patiënten met bloedkanker, lymfklierkanker, multipel myeloom en voor patiënten die een stamceltransplantatie hebben ondergaan.
Stichting Hematon
Postbus 8152
3503 RD Utrecht
Tel. 030-760 34 60
E-mail: secretariaat@hematon.nl
Website: www.hematon.nl
Deze vereniging zet zich in voor alle patiënten met leukemie, dat wil zeggen acute leukemie (ALL en AML) maar ook de verschillende vormen van chronische leukemie.
Revalidatieprogramma Herstel & Balans
Daarnaast is er voor patiënten die de behandeling achter de rug hebben en moeite hebben de draad weer op te pakken, de mogelijkheid gebruik te maken van het revalidatieprogramma Herstel & Balans. Dit programma is op zestig locaties in Nederland beschikbaar, onder meer ook in het UMCG, via het Centrum voor Revalidatie, locatie Beatrixoord. Dit programma is gericht op het verminderen van klachten zoals vermoeidheid, pijn, angst en neerslachtigheid. Daardoor verbetert de kwaliteit van leven.
Een (ex-)patiënt kan aan Herstel & Balans deelnemen nadat de behandelingen tegen kanker zijn afgerond. Bij de start van de revalidatie moet de conditie zodanig zijn dat de persoon zich redelijk kan bewegen en aan het groepsprogramma kan deelnemen. De arts kan de patiënt verwijzen naar Herstel & Balans als de behandeling is afgerond en de kans op herstel aannemelijk is.
Veel zorgverzekeraars vergoeden de revalidatie via de aanvullende verzekering.
Nazorg: Het Behouden Huys
Het valt niet altijd mee om met een ziekte als kanker om te gaan. Er komt verschrikkelijk veel op iemand af. Eerst de klap van de diagnose, dan de vaak ingrijpende medische behandelingen. En hoe verder daarna? Hoe gaat iemand bijvoorbeeld om met een veranderd lichaam, met vermoeidheid of een onzeker levensperspectief? Het kan daarom heel wenselijk zijn om na(ast) de medische zorg gebruik te maken van extra ondersteuning door Het Behouden Huys.
Het Behouden Huys is gelegen op het prachtige landgoed De Vijverberg te Haren. Het is een bijzondere plek waar kankerpatiënten en hun naasten onder professionele en vooral ook betrokken begeleiding stil kunnen staan bij de lichamelijke, psychische en sociale gevolgen van hun ziekte. Er is begeleiding mogelijk voor iedereen, ongeacht de leeftijd, ziektefase, prognose of het stadium van het ziekteproces.
Wilt u meer weten, zie dan: www.behoudenhuys.nl.




