Introductie
Flowcytometrie heeft een belangrijke rol in de diagnose en follow-up van hematologische maligniteiten. Met behulp van de juiste combinatie van markers kan onderscheid gemaakt worden tussen onrijpe en rijpcellige maligniteiten, kan de cellijn vastgesteld worden (myeloïd, T-cel, B-cel, mixed, etc) of kan een voorkeur voor een subentiteit worden gegeven. Tevens kunnen markers gebruikt worden die bij maligniteiten differentieel tot expressie komen t.o.v. hun normale tegenhangers, om zo bij follow-up te zoeken naar residuele maligne cellen in een polyklonale achtergrond. Afhankelijk van het aantal opgenomen cellen kan dit tot een gevoeligheid van 10-4-10-6, dit staat ook wel bekend als measurable residual disease (MRD) onderzoek o.b.v. leukemie geassocieerd fenotype (LAF). Op basis van grondige kennis van normale uitrijpingspatronen kan bij follow-up binnen m.n. AML ook worden gekeken naar uitrijpingspatronen die afwijken t.o.v. normaal om zo vroegtijdig recidiverende ziekte op te sporen; dit is de zogenaamde different-from-normal approach.
Hieronder worden de flowcytometriemarkers van een aantal hematologische maligniteiten behandeld, waarbij de WHO 2017 classificatie als leidraad dient. De werkelijkheid is echter weerbarstiger en niet alle nuances en uitzonderingen kunnen hier benoemd worden.
Acute Leukemie
Voor de diagnose van acute leukemie wordt een panel van cellijndefiniërende markers gecombineerd met stamcelmarkers.
| Myeloïd: | MPO of monocytaire differentiatie (≥2: CD11c, CD14, CD64, NSE en lysozyme (de laatste twee zijn geen flowmarkers) |
| T-lijn: | CD3 (cytoplasmatisch (c) of membraan (s)) |
| B-lijn | CD19 sterk en ≥1 van CD79a, CD22, CD10 of CD19 zwak en ≥2 van CD79a, CD22, CD10 |
N.B. Bovenstaande hanteert de WHO in geval van Mixed Phenotype Acute Leukemia (MPAL), maar wordt algemeen gebruikt als basis voor cellijn definitie. Myeloïde markers als CD13 en CD33 komen frequent voor op lymfatische leukemie en lymfatische markers als CD7, CD19 en CD22 komen regelmatig voor op AML, dan is pas sprake van MPAL als aan bovenstaande wordt voldaan. Buiten MPAL om is ook sprake van AML indien MPO negatief, maar positief voor ≥2 van CD117, CD13 en CD33 (dus in afwezigheid van T- en B-cel definiërende markers).
Aanvullend geldt binnen AML:
- CD235 definiërend voor erytroïde uitrijping
- CD41/CD61 definiërend voor megakaryocytaire uitrijping
Immaturiteit definiërend
| Myeloid | CD34 en/of CD117 op een deel of alle cellen* CD38 en HLA-DR in afwezigheid van rijpheidsmarkers |
| Monocytair | CD14neg bij CD64 en CD11c positiviteit of CD300e negativiteit op monocytaire cellen (conform Euroflow) |
| T | CD1a, cCD3+/sCD3-, CD10, CD34, TdT, CD99 |
| B | CD34, TdT, CD10**, cIg+/sIg-** |
CD45 expressie kan behulpzaam zijn: neg of zwak is suggestief voor immaturiteit
*Het onderscheid met promyelocyten is niet eenduidig, deze zijn normaliter CD117+/HLA-DR-
**CD10+ en cIg+/sIg- kunnen ook bij rijpe maligniteiten voorkomen (de combinatie met andere markers is hierbij belangrijk).
Opmerkingen t.b.v. B-ALL
- Het is behulpzaam om het differentiatie stadium te benoemen:
- pro-B ALL: expressie van CD19, cCD79a, CD22 en TdT
- common B-ALL: CD19, cCD79a, CD22, TdT en CD10
- pre-B ALL: CD19, cCD79a, CD22, cIgM, soms sIgM zonder lichte keten (dan transitionele pre-B ALL)
- Therapeutisch is het van belang om de mate van CD20 expressie van de B-ALL blasten vast te stellen. Indien CD20 tot expressie komt op ≥20% van de blasten wordt gesproken van een CD20-positieve B-ALL en wordt anti-CD20 therapie aan de behandeling toegevoegd.
- In het kader van MRD worden de markers CD38, CD66c, CD73, CD81, CD123 en CD304 gemeten, omdat deze in B-ALL vaak een andere expressie kennen dan normale B-cel precursors (hematogonen).
Opmerkingen t.b.v. T-ALL
- Overige pan T-cel markers (CD2, CD5 en CD7) zijn vaak positief, maar kunnen negatief, verzwakt of versterkt zijn
- Het kan behulpzaam zijn om het differentiatie stadium te benoemen:
- Pro-T-ALL: cCD3+/CD7+ (sCD3-)
- Pre-T-ALL: cCD3+ en ≥1 van CD2, CD5, CD8. sCD3 zwak of partieel is toegestaan en sluit ALL niet uit
- Early T-cell precursor (ETP) ALL – provisional entity in WHO 2017: CD7+, CD5 meestal neg of zwak (in <75% van de blasten) en CD1a en CD8 per definitie negatief; indien CD5 duidelijker positief dan near-ETP-ALL. ≥1 myeloïde/stamcelmarker positief: CD34, CD117, HLA-DR, CD11b, CD13, CD33, CD65; CD2 en CD4 kunnen positief zijn; sCD3 zwak of partieel is toegestaan en sluit ALL niet uit.
- Cortical-T-ALL: CD1a+ (vaak CD4+/CD8+). sCD3 zwak of partieel is toegestaan en sluit ALL niet uit
- Rijpe/medullaire T-ALL: CD1a-neg, sCD3+ (sterk als normaal) of zwak, maar met TCR+ (zeer moeilijke diagnose, vrijwel niet te onderscheiden van rijpe T-celmaligniteit)
BPDCN (Blastair Plasmacytoïd Dendritisch Cel Neoplasma)
- Kenmerk: Hematologische maligniteit van voorlopers van plasmacytoïde dendritische cellen met lokalisaties in huid, bloed en beenmerg.
- Kenmerkend immuunfenotype: CD4, CD43, CD56, CD45RA, cTCL1 en CD123 sterk, in afwezigheid van cMPO, cCD3 en CD19
Rijpcellige hematologische maligniteiten
Plasmaceldyscrasiën
Non-IgM MGUS, AL-amyloïdose en multiple myeloom hebben een afwijkend immuunfenotype dat heel goed te onderscheiden is van normaal, wat de mogelijkheden voor betrouwbare MRD-monitoring ten goed komt.
Plasmacellen worden voornamelijk gedefinieerd o.b.v. sterke expressie van CD38
Normale plasmacellen: CD38 sterk, CD138, CD45, CD19, CD81, CD27 en negatief voor CD20, CD56, CD117
Non-IgM PCD: CD38 sterk, CD138, expressie van CD56, CD117 en verlies of verzwakte expressie van CD45, CD19, CD81 en CD27. Niet al deze afwijkingen komen gelijktijdig voor, dit is patiënt afhankelijk en ≥2 afwijkingen is wel gangbaar. Zeer zeldzame IgM MM is te onderscheiden van LPL o.b.v. bovenstaande markers en afwezigheid van klonale B-cellen
IgM MGUS / LPL: als normaal, maar overmaat of klonale synthese van IgM kappa/lambda en aanwezigheid van klonale B-cellen. MRD op LPL is zeer lastig door ontbreken van afwijkende markerexpressie.
N.B. gebruik van anti-CD38 therapie of verlies/verzwakking van CD38 kan de identificatie van MRD-MM sterk beïnvloeden. Er wordt gebruik gemaakt van anti-CD38 monoklonale antilichamen die plasmacellen ook bij anti-CD38 therapie kunnen aantonen.
Rijpe B-cel maligniteiten
Voor de rijpe B-celmaligniteiten (CD19+, CD34-, TdT-, CD20+, sIg+) is flowcytometrie essentieel voor de diagnose van CLL en HCL(v), voor de andere entiteiten is flowcytometrie ondersteunend aan de pathologie.
Chronische lymfatische leukemie (CLL)
- >5×109/L monoklonale B-cellen met karakteristiek immuunfenotype: CD19+, CD5+, CD20 zwak, k/l zwak, zware ketens zwak (meestal IgM/IgD), CD79b zwak/negatief, CD23+, CD43+, CD200+
- Atypische expressie van bovenstaande markers is mogelijk, bv sterke expressie van CD20, CD79b en/of lichte/zware ketens en in een zeldzaam geval zelfs CD5-; in deze gevallen is het essentieel andere B-cel maligniteiten uit te sluiten, m.n. MCL en MZL.
- Progressie naar PLL-mengbeeld geeft doorgaans geen ander fenotype, behoudens een licht verhoogde forward scatter (FSC – maat voor grootte van de cel)
- <5×109/L is sprake van een MBL of SLL, waarbij bij MBL onderscheid wordt gemaakt tussen
- Low count MBL: <0.5×109/L
- High count MBL: 0.5-5×109/L
- CLL-type MBL (fenotype als boven)
- Atypical CLL-type MBL: CD19+, CD5+, CD20+ (sterk) en/of sterkere expressie van lichte/zware ketens en/of CD23-
- Non-CLL-type MBL: CD5 of zwak, CD20+ (sterk), sterkere expressie van licht/zware ketens; zeker hier dienen lymfomen zorgvuldig te zijn uitgesloten
Mantel cel lymfoom (MCL)
- Karakteristiek immuunfenotype: CD19+, CD5+, CD20+, lichte/zware ketens normaal tot sterk (meestal IgM/IgD en vaker lambda), CD79+, CD23- of zwak, CD200-
- Afwijkingen t.o.v. bovenstaande mogelijk, m.n. in blastaire variant. De niet-nodale MCL kan CD200 positief zijn.
- Er kan hooguit een voorkeur voor MCL worden uitgesproken, ondersteuning moet volgen uit PA (o.a. Cycline D1, SOX11 bepaling) en cytogenetica (t(11;14)
Folliculair lymfoom (FL) en andere kiembaan lymfomen
- Karakteristiek immuunfenotype: CD19+, CD5-, CD20+, CD10+, CD38+, lage FSC (kleincellig)
- Soms CD5+ of verlies van CD10
- Er kan hooguit een voorkeur voor FL worden uitgesproken, ondersteuning moet volgen uit PA (o.a. BCL2, BCL6 bepaling) en cytogenetica (t(14;18)
- Onderscheid met CD10+ DLBCL en Burkitt wordt m.n. gemaakt o.b.v. FSC i.c.m. morfologie en CD43+ bij Burkitt.
Hairy Cell Leukemia (HCL) en HCL-variant:
- Karakteristiek immuunfenotype: FSC+, SSC++ (side scatter – meer lichtverstrooing door harig cytoplasma), CD19+, CD5-. CD20++, CD10-, CD103+, CD11c+, CD25+, sterke expressie van lichte en zware ketens
- HCLv als klassieke HCL, maar CD25-
- t.t. HCLv wordt HCL gekenmerkt door monocytopenie. Door de hoge zijwaartse lichtverstrooing kunnen de maligne cellen in de flowcytometer, maar ook in de algemene celteller(!) op de plek van de monocyten gaan liggen en voor monocyten worden aangezien.
Overige rijpe B-cel maligniteiten
- overige maligniteiten als B-PLL en MZL/SLVL hebben geen karakteristiek fenotype en zullen doorgaans als B-NHL NOS worden uitgeslagen. SLVL heeft vaak een ligt verhoogde side scatter en mist de andere typerende markers als CD5, CD10 of CD103, hoewel CD5 in soms voorkomt; in samenhang met morfologie kan een voorkeur worden uitgesproken.
- LPL wordt gekenmerkt door expressie van IgM als zware keten, i.c.m. IgM+ klonale plasmacellen zonder verder typerend fenotype.
Tabel 1. Overzicht van meest karakteristieke markerprofielen voor de meest voorkomende perifere B-cel maligniteiten (B-PLL en MZL/SLVL kennen geen karakteristiek immuunfenotype).
| CLL | MCL | HCL | HCLv | Geminal Center lymfomen | LPL | |
| CD45 | + | + | + | + | + | + |
| CD19 | + | + | + | + | + | + |
| CD20 | zw | + | +/++ | +/++ | + | + |
| Kappa/Lambda | zw | + | + | + | + | + |
| CD5 | + | + | – | – | – | – |
| CD10 | – | – | – | – | + | – |
| CD103 | – | – | + | + | – | – |
| CD11c | – | – | +/++ | +/++ | – | – |
| CD23 | + | – | n.v.t. | n.v.t. | n.v.t. | n.v.t. |
| CD200 | + | – | n.v.t. | n.v.t. | n.v.t. | n.v.t. |
| CD38 | n.v.t. | 30-40% pos | n.v.t. | n.v.t. | n.v.t. | Vaak + |
| CD25 | n.v.t. | n.v.t. | + | – | n.v.t. | Vaak + |
| CD79b | -/zw | + | + | + | + | + |
| CD43 | + | -/zw | n.v.t. | n.v.t. | n.v.t. | n.v.t. |
| Surface Ig | Zw (vaak IgM/IgD) | + (IgM/IgD) | +/++ | +/++ | + | + (IgM) |
| FSC | Laag | Laag (hoog bij blastaire variant) | verhoogd | verhoogd | FL: Laag; BL en DLBCL hoog | laag |
| SSC | laag | laag | verhoogd | verhoogd | FL en BL laag; soms hoog bij DLBCL | laag |
Rijpe T-cel maligniteiten
Rijpe T-cel maligniteit zijn uitdagend met flow cytometrie, temeer daar systemische lokalisatie van cutane of nodale T-cel maligniteiten soms zeer beperkt is.
T-cell large granular lymphocyte (T-LGL) Leukemia
De meest voorkomende T-cel afwijking in bloed en beenmerg is T-LGL-leukemie.
Toelichting klonaliteit T-cellen.
Tot voorkort was er i.t.t. rijpe B-cel maligniteiten (restrictie van kappa of lambda) geen echte klonaliteitsmarken voorhanden binnen de flowcytometrie. Recent is hier een marker voor gekomen, de zogenaamde TCRB1, Constante domein van de T-cel Receptor Beta keten 1, zie figuur. Elke T-cel met αβ-TCR, heeft als keus voor het constante domein voor de β-keten ‘keuze’ uit type 1 of type 2; deze wordt random afgeschreven. In een normale T-cel pool zal dus een deel TCRB1 en TCRB2 aanwezig zijn. Tegen TCRB2 heeft met tot heden nog geen geschikte monoklonale antistof kunnen maken. Het is te vergelijken met B-cellen waarvoor alleen kappa voorhanden is. Met flowcytometrie zal een klonale T-cel of positief of negatief zijn. In het geval van een negatieve TCRB1 moet uitgesloten worden dat het γδ-T-cellen betreft, deze hebben immers geen β-keten.
Het toepassen van deze marker leidt tot het vinden van veel kleine (sub)klonale T-cellen, voorzichtigheid is geboden bij de interpretatie van deze klonen. De term TCUS (T-cell clones of uncertain significance) wordt hier al voor geopperd, zie Horna et al.
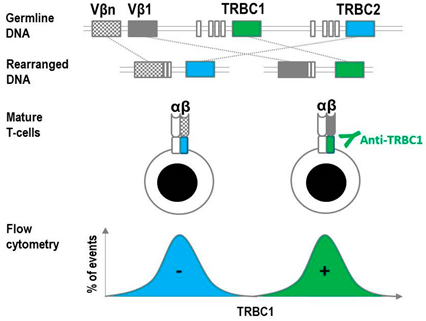
Figuur 1. Schematische weergave van afschrijven van TCRB1. Horna et al.
T-cellen worden gedefinieerd via CD3 (surface) en zijn verder positief voor de pan-T-cel markers CD2, CD5 en CD7 en zijn CD4 of CD8, waarbij kleine populaties dubbel positief en negatief voorkomen. De meeste T-cellen zijn TCR-αβ en een klein deel is TCR-γδ. De γδ-T-cellen zijn CD4/CD8 dubbel negatief, waarbij een deel CD8 (zwak) positief is. In geval van T-cel maligniteiten kan verlies van één of meerdere van deze markers optreden, deze aberraties zijn weinig specifiek en ook binnen een entiteit vrij heterogeen. Er zijn een aantal additionele markers die meer informatie geven over de verschillende subtypes.
T-cel prolymfocyten leukemie (T-PLL)
Karakteristiek immuunfenotype: CD3+ of verzwakt, CD2+, CD5+, CD7+/++, cyTCL1, CD4+/CD8- (60%), CD4+/CD8+ (25%), CD4-/CD8+ (15%). CD4+/CD8+ kan ook bij corticale T-ALL worden gezien (T-ALL uitsluiten), maar wordt bij andere rijpe T-celmaligniteiten slechts zelden gezien. De meest karakteristieke marker is cyTCL1, wat bij andere maligniteiten niet wordt gezien en waarschijnlijk het gevolg is van mutaties/translocaties van chromosoom 14 waar het TCL-1 proto-oncogen gelegen is.
T-cel Large Granular Lymphocytic Leukemia (T-LGLL)
Karakteristiek immuunfenotype: CD3+, CD8+, CD2+, CD5+, CD7+ (of verzwakt), CD57+, CD11c+, CD16+, CD94+, cyGranzyme+, cyPerforine+. Verlies van pan T-celmarkers kan optreden. De meeste T-LGLL zijn CD8+ cytotoxische T-cellen, maar ook CD4+ of CD4+/CD8+ klonen komen voor. Expressie van NK-cel markers CD11c, CD16 en/of CD94 komen voor en homogeen sterke expressie van m.n. CD16 en CD94 past bij klonale T-LGL. Expressie van CD56 kan voorkomen en zou prognostisch slechter zijn.
T-LGL cellen komen bij iedereen voor in meer of mindere mate en zeker in reactieve condities of na stamceltransplantatie. De bona fide cellen zijn morfologisch en immuunfenotypisch lastig te onderscheiden van maligne T-LGL cellen, hoewel de klonaliteitsmarker TCRB1 daar nu rap verandering in brengt. Er is geen duidelijke overeenkomst over het benodigde aantal maligne cellen: een persisterende (>6 maanden) perifere T-LGL lymfocytose >2×109/L is passend bij T-LGLL, maar bij persisterende en niet anderszins verklaarde cytopenieën (m.n. neutropenie) of geassocieerde ziekten/symptomen (terugkerende infecties, auto-immuun aandoeningen (m.n. RA)) kan de diagnose ook worden overwogen bij >0.5×109/L T-LGL cellen (Lamy et al. 2017).
NK-LGL
Karakteristiek immuunfenotype: sCD3-, cCD3-, CD56+, CD2+, CD5-, CD7+, CD4-/CD8-, CD11c+, CD16+, CD57+, CD94+.
CD2 en CD7 kunnen verzwakt of negatief zijn, m.n. bij de agressieve variant, in welk geval CD57 vaker negatief is. CD8 is soms positief. Omdat er geen TCR aanwezig is, is klonaliteit niet aan te tonen.
Mycosis Fungoides / Sezary Syndrome (MF/SS)
Karakteristiek immuunfenotype: CD3+, CD4+, CD5+, CD7-, CD26-
MF en SS zijn twee verschillende ziektes, maar met sterk overlappende morfologie en immuunfenotypes. Het meest typerende fenotype is CD7-/CD26-, maar CD7+/CD26- en CD7-/CD26+ populaties komen ook frequent voor en populaties in het bloed kunnen qua fenotype verschillen van de fenotypes in de huid. Ook afwijkende expressie van CD2, CD3, CD4 en in mindere mate CD5, komt frequent voor. CD279 (PD1) komt vaak tot overexpressie en ook CD30 kan positief zijn, zij het minder frequent. Het bepalen van het absolute aantal ‘Sezary’ cellen is volgens de laatste richtlijnen nodig voor de stadiëring van de ziekte. De morfologie met middelgrote lymfocyten met typische cerebriforme kernen kan behulpzaam zijn (indien aanwezig).
Adult T-cell Lymphoma (ATLL)
Karakteristiek immuunfenotype: CD3+, CD2+, CD4+, CD5+, CD25+, CD7-.
De meest typerende marker is CD25 die in vrijwel alle gevallen homogeen positief is en vrijwel niet bij andere leukemische T-celmaligniteiten voorkomt. De morfologie met typische ‘flower cells’ kan behulpzaam zijn. Indien getransformeerd kunnen de cellen CD30 tot expressie brengen, waarbij de grote afwijkende cellen moeilijk te onderscheiden van ALK-/+ grootcellige anaplastische T-cellymfomen, die naast CD30 ook CD25 tot expressie kunnen brengen.
Angio-immunoblastair T-cel lymfoom (AITL)
Karakteristiek immuunfenotype: CD3+, CD4+, CD2+, CD5+, CD10+, CD279+ (PD1). De lymfoomcellen hebben een T-helper-cel fenotype: CD4+, CD10+, CD279+. CD2 en CD5 zijn meestal positief, maar CD3 en CD7 zijn regelmatig afwijkend. Onderscheid met het veel zeldzamere folliculair T-cellymfoom lijkt niet goed mogelijk met flowcytometrie.
PD1 (CD279) is regelmatig positief, maar niet specifiek. De morfologie met typische ‘flower cells’ kan behulpzaam zijn. Indien getransformeerd kunnen de cellen CD30 tot expressie brengen, waarbij de grote afwijkende cellen moeilijk te onderscheiden van ALK-/+ grootcellige anaplastische T-cellymfomen, die naast CD30 ook CD25 tot expressie kunnen brengen.
PTCL, NOS
Deze heterogene groep maakt 30% van de perifere T-cellymfomen uit en kent geen typerend fenotype of marker. Meestal betreft het CD4+ cellen met frequent verlies van CD5 en/of CD7, andere combinaties van CD4 en CD8 komen soms voor.
Tabel 2. Overzicht van meest karakteristieke markerprofielen voor de meest voorkomende perifere T-cel maligniteiten
| T-LGLL | NG-LGL | T-PLL | ATLL | AITL | MF/SS | PTCL-NOS | |
|---|---|---|---|---|---|---|---|
| CD45 | + | + | + | + | + | + | + (-) |
| CD3 | + | – | + | + | +/zw | + | + (-) |
| CD4 | – | – | + | + | + | + | + |
| CD8 | + | – (+) | Zie tekst | – | – | – | – (+) |
| CD2 | + | +/- | + | + | + | + | + (-) |
| CD5 | zw | + | + | + | + | + | – (+) |
| CD7 | + | +/++ | +/++ | – | + (-) | – | – (+) |
| CD10 | – | – | – | – | + | – | – |
| CD25 | – | – | – | + | – | – | – |
| CD26 | nvt | nvt | nvt | nvt | nvt | + | nvt |
| CyTCL1 | – | – | + | – | – | – | – |
| CD30 | – | – | – | – | – | – | in 50% deels + |
| CD279 (PD1) | nvt | nvt | nvt | nvt | + | + (-) | nvt |
| CD56 | – | + | – | – | – | – | – |
| CD57 | + | + | – | – | – | – | – |
| CD11c | + | + | – | – | – | – | – |
| CD16 | + | + | – | – | – | – | – |
| CD94 | + | + | – | – | – | – | – |
| Perforine/Granzyme | + | + | – | – | – | – | – |
Literatuurlijst
- Swerdlow et al. 2017 – WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues
- Theunissen et al. 2017 – Blood 2017; 129(3):347-357 – https://doi.org/10.1182/blood-2016-07-726307
- Van Dongen et al. 2012 – Leukemia; 26: 1908–1975 – https://doi.org/10.1038/leu.2012.120
- Concept aanbeveling NVC/IMCD (Nederlandse Vereniging voor Cytometrie / SKML sectie Immunologische en Moleculaire CelDiagnostiek)
- Horna et al. 2021 – Internation Journal of Molecular Sciences 2021; 22(4) 1817 – https://doi.org/10.3390/ijms22041817
- Lamy et al. 2017 – Blood (2017); 129 (9): 1082–1094 – https://doi.org/10.1182/blood-2016-08-692590




