Inleiding
Van de cerebrale tumoren is 4% lymfoom. Primair centraal zenuwstelsel (PCZSL) maakt 1% uit van de NHL’s en komt voor bij 4 op de 1.000.000 personen per jaar. De mediane leeftijd is 65 jaar. Predisponerende factor is immunodeficiëntie; HIV dan wel door therapie. PCZSL komt ook voor bij immunocompetente patiënten. Per definitie is er geen systemische lokalisatie, lymfoom van de dura behoort niet bij PCZSL. 15-25% van de patiënten heeft lokalisatie in het oog (glasvocht, retina, choroid), dit kan de enige lokalisatie zijn; dan spreken we van een primair vitreoretinaal lymfoom. EBER is zelden positief in PCZSL. Indien positief moet een onderliggende immuundeficiëntie of dysregulatie worden uitgesloten. Het is van belang om snel diagnostiek te verrichten en pas daarna eventueel te starten met steroïden.
Diagnose
De diagnose wordt bij voorkeur gesteld op basis van een histologisch biopt volgens de meest recente WHO classificatie. Er is hierbij geen klinisch voordeel van een resectie, dus waar mogelijk volstaat een stereotactische biopsie. Indien een hersenbiopt niet mogelijk/ haalbaar is, kan de diagnose ook gesteld worden door een combinatie van typische bevindingen bij MRI en monoklonale B-cellen bij immunofenotypering op liquor (slechts bij 15% afwijkend), ondersteund door een positieve MYD88 mutatie op liquor (niet noodzakelijk). Bij solitaire ooglokalisatie kan vitrectomie de diagnose bevestigen.
Work-up
- Anamnese: WHO performance status, B-symptomen
- Lichamelijk onderzoek
- Laboratoriumonderzoek; bloedbeeld, nierfunctie, levertesten, LDH, albumine, calcium, fosfaat, urinezuur, INR
- Serologie: HIV, HTLV1/2, HBV, HCV, Lues, Toxoplasma
- MRI met contrast van brein
- MRI totale wervelkolom bij myelopathie of radiculopathie
- PET-CT ter uitsluiting van systemische lokalisatie lymfoom met secundaire CZS lokalisatie (occult lymfoom bij 8-10%)
- Beenmergonderzoek heeft geen meerwaarde
- Lumbaal punctie voor chemie, flowcytometrie en moleculair onderzoek zo mogelijk. Bij 60-80% is er sprake van MYD88 mutatie,.
- Indien bij diagnose een lumbaal punctie niet verricht kan worden, wordt geadviseerd na initiële behandeling (na 1 kuur) alsnog een diagnostische LP te verrichten
- Evaluatie cognitieve functies met MMSE ter overweging
- Consult/ medebehandeling neurologie
- Consult oogarts (15-25% oculaire betrokkenheid), bij lokalisatie dient oogheelkundig onderzoek herhaald te worden bij response-evaluatie.
- Consult fertiliteit bij AYA’s
Prognose
Voor een risico inschatting wordt het gebruik van MSKCC model aanbevolen, dit model is gebaseerd op een retrospectieve analyse bij 338 patiënten tussen 1983 en 2003. Dit model beschrijft drie risicogroepen.
- Goed risico (<50 jaar)
- Intermediair risico (≥50 jaar en een KPS score van ≥70).
- Slecht risico (>50 jaar en KPS score < 70)
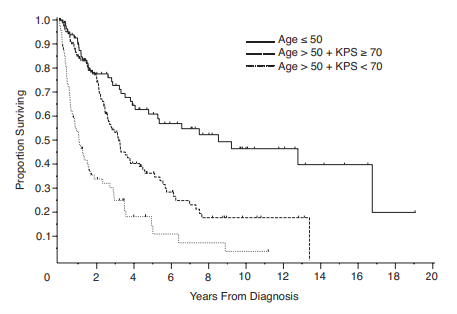
De International Extranodal Lymphoma Study Group (IELSG) score wordt veel gebruikt maar is niet extern gevalideerd en daarnaast weinig getest bij patiënten > 70 jaar.
Eerstelijnsbehandeling bij fitte patiënt
Op dit moment zijn er geen studies/ trials in het UMCG waar patiënten in geïncludeerd kunnen worden. Kijk voor een actief overzicht op de website hematologie Groningen.
Bij fitte patiënten worden de beste resultaten bereikt door middel van inductie met MTX-en cytarabine-bevattende schema’s gevolgd door consolidatie met autologe stamceltransplantatie. Hierbij zijn er meerdere therapie-schema’s mogelijk.
In de 1e lijn is er in principe geen plek voor consolidatie met whole-brain radiotherapie (WBRT) bij fitte patiënten, mede gezien neurotoxiciteit op lange termijn en betere data bij consolidatie d.m.v. autologe stamceltransplantatie. Bij patiënten tot 60 jaar kan WBRT als alternatief overwogen worden in individuele gevallen met verhoogd risico op non-relapse mortality (NRM) bij ASCT.
In Nederland is in de 1e lijn vooral ervaring met MBVP gevolgd door HD-ARAC (hoge dosis cytarabine) en met het MATRIX schema. Op basis van de eerdere HOVON 105 trial zien wij geen standaard plaats voor rituximab in de 1e-lijnsbehandeling met MBVP. Op basis van lange termijn data van de HOVON 105 (Houillier et al, 2022) en de IELSG32 trial (Ferreri et al, 2017) kan rituximab worden overwogen bij jonge patiënten vanwege een reductie in EFS (event free survival); waarnaast in de IELSG32 na 88 maanden een significante betere OS bij rituximab (+/- thiotepa) werd gezien. Dit is echter geen vergelijkende studie met MBVP, maar hier is vergeleken met behandeling met alleen MTX en cytarabine. Vanwege veel ervaring wordt in Groningen gekozen voor het MBPV schema, gevolgd door cytarabine.
1e-lijnsbehandeling:
- 2 kuren MBVP
- Responsbeoordeling middels MRI cerebrum
- 1-2 kuren HD-ARAC, afhankelijk van respons, bij minstens PR (partiële respons)
- Autologe stamceltransplantatie
Overwegingen:
- Bij patiënten tot 60 jaar kan WBRT als alternatief overwogen worden in individuele gevallen met verhoogd risico op non-relapse mortality (NRM) bij ASCT.
- Intrathecale behandeling dient niet standaard toegevoegd te worden. Bij respons obv MRI, maar een persisterende liquorlokalisatie kan MTX IT (2x/ week tot remissie) overwogen worden
- Bij oculaire betrokkenheid dient dezelfde behandelstrategie gevolgd te worden, bij keuze voor WBRT dient dan wel bilaterale oculaire radiotherapie te worden toegevoegd
Eerstelijnsbehandeling bij niet-fitte patiënt
Patiënt >70 jaar hebben een 5-jaarsoverleving van 6% tegenover 30% bij patiënten <70 jaar. Uit data van de Nederlandse kankerregistratie (NKR, 2014-2017) blijkt dat patiënten behandeld met chemotherapie het significant beter doen. De 2-jaars OS was 45% in die groep. De uitdaging is om de patiënten te selecteren die de HD-MTX-bevattende schema’s aankunnen.
Bij patiënten die fit genoeg zijn voor chemotherapie, maar niet in aanmerking komen voor een stamceltransplantatie wordt voorgesteld het zelfde schema als bovengenoemd te volgen. Ook zonder consolidatie met autologe stamceltransplantatie kan een CR worden bereikt.
Alternatieven zijn WBRT, eventueel in combinatie met dexamethason, of best supportive care.
Respons en follw-up
Respons evaluatie gebeurt bij voorkeur door neuroloog en hematoloog samen. Voor evaluatie na de behandeling dient de 1e 2 jaar na behandeling elke 3 maanden een MRI verricht te worden. Bij eerdere betrokkenheid wordt geadviseerd ook LP’s en oogonderzoek in de follow-up mee te nemen.
Het valt te overwegen om de follow-up na behandeling over te dragen aan de neuroloog met kennis van neuro-oncologie, indien de acute toxiciteit van de systemische behandeling voorbij is.
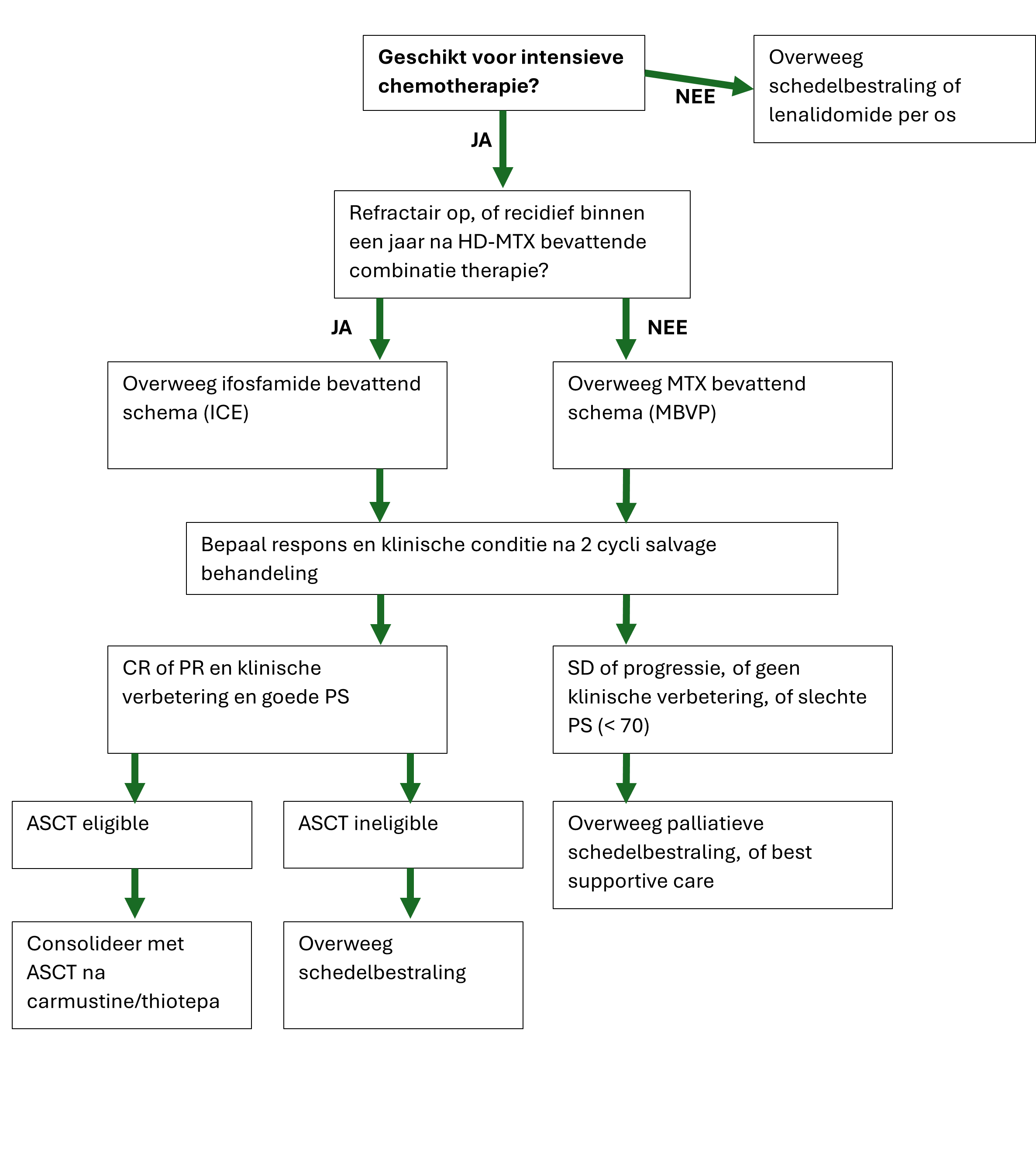
Tweedelijnsbehandeling. R/R PCZSL
De keuze voor behandeling bij een refractair of recidief PCZSL dient volledig geïndividualiseerd te worden. Van invloed op de keuze van therapie zijn:
Leeftijd, vitaliteit, duur van remissie, voorafgaande behandeling/radiotherapie en lokalisatie van de ziekte. In Nederland is bij een laat recidief ervaring met herhalen van MBVP; te overwegen bij langere remissieduur. Daarnaast is re-inductie met als basis HD-ARA-C beschreven (Soussain) of re-inductie met als basis ifosfamide; in Nederland is de meeste ervaring met ICE. Bij responsieve ziekte kan in selecte gevallen geconsolideerd worden met autologe SCT indien dit nog niet eerder was gegeven.
Lenalidomide wordt vergoed voor de indicatie recidief DLBCL en is daarmee ook voor PCZSL vergoed.
Onderstaand schema biedt handvaten voor therapie keuze bij een refractair of recidief PCZSL. Het schema volgt in hoofdlijnen de nCCN en Britse richtlijnen.
Literatuurlijst
- Abrey LE, Batchelor TT, Ferreri AJ, Gospodarowicz M, Pulczynski EJ, Zucca E, Smith JR, Korfel A, Soussain C, DeAngelis LM, Neuwelt EA, O’Neill BP, Thiel E, Shenkier T, Graus F, van den Bent M, Seymour JF, Poortmans P, Armitage JO, Cavalli F. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma. International Primary CNS Lymphoma Collaborative Group. J Clin Oncol 2005; 23(22): 5034-43.
- Gavrilovic IT, Hormigo A, Yahalom J, DeAngelis LM, Abrey LE. Long-Term Follow-Up of High-Dose Methotrexate-Based Therapy With and Without Whole Brain Irradiation for Newly Diagnosed Primary CNS Lymphoma. J Clin Oncol 2006; 24(28):4570-4.
- Poortmans PM, Kluin-Nelemans HC, Haaxma-Reiche H. High-Dose Methotrexate-Based Chemotherapy Followed by Consolidating Radiotherapy in Non–AIDS-Related Primary Central Nervous System Lymphoma EORTC Cancer Lymphoma Group Phase II Trial. J Clin Oncol 2003; 21:4483-4488.
- AJM Ferreri, M Reni, M Foppoli, on behalf of the International Extranodal Lymphoma Study Group (IELSG). High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial. Lancet 2009; 374: 1512–1520.
- Enting RH, Demopoulos A, DeAngelis LM, Abrey LE. Salvage therapy for primary CNS lymphoma with a combination of rituximab and temozolomide. Neurology 2004;63(5):901-903.
- Soussain C, Hoang-Xuan K, Taillandier L et al. Intensive Chemotherapy Followed by Hematopoietic Stem-Cell Rescue for Refractory and Recurrent Primary CNS and Intraocular Lymphoma: Societe Francaise de Greffe de Moelle Osseuse-Therapie Cellulaire. J Clin Oncol 2008;28:2512-2518.
- Houillier et al. Radiotherapy or Autologous Stem-Cell Transplantation for Primary CNS Lymphoma in Patients 60 Years of Age and Younger: Results of the Intergroup ANOCEF-GOELAMS Randomized Phase II PRECIS Study. J Clin Oncol. 2022 Nov 10;40(32):3692-3698
- Ferreri et al. Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. Lancet Haematol. 2017 Nov;4(11):e510-e523
- Bromberg et al. Survival, neurocognitive function, and health-related quality of life outcomes after rituximab—methotrexate, BCNU, teniposide, and prednisolone for primary CNS lymphoma: Final results of the HOVON 105/ALLG NHL 24 study. Neuro Oncol. 2024 Apr; 26(4): 724–734
- Ferreri et al. Long-term efficacy, safety and neurotolerability of MATRix regimen followed by autologous transplant in primary CNS lymphoma: 7-year results of the IELSG32 randomized trial. Leukemia. 2022 Jul;36(7):1870-1878
- Calimeri et al. How we treat primary central nervous system lymphoma. ESMO Open. 2021 Aug;6(4):100213.
- NCCN Guidelines Version 1.2022, Primary CNS Lymphoma
- Fox et al. Guidelines for the diagnosis and management of primary central nervous system diffuse large B-cell lymphoma. Br J Haematol 2019 Feb;184(3):348-363.
- Abrey et al. Primary centrel nervous system lymphoma: the Memorial Sloan-Kettering Cancer Center Prognostic Model. J Clin Oncol. 2006 Dec 20;24(36):5711-5.




