CML is een myeloproliferatieve aandoening die ontstaat uit abnormale hematopoïetische stam- en progenitorcellen en die geassocieerd is met het BCR-ABL1 fusiegen. Het ziektebeloop kan mono-, bi- of trifasisch verlopen. Meestal presenteert CML zich met een indolente chronische fase, soms gevolgd door een geaccelereerde fase en of heel zelden gevolgd door een blastencrisis. Sinds de komst van de tyrosine-kinaseremmers (TKI’s) is de kans op acceleratie en blastencrisis sterk verminderd.
Diagnostiek
- Anamnese: familiair, voorgeschiedenis (met extra aandacht voor cardiovasculaire problemen), intoxicaties;
- LO: Standaard lichamelijk onderzoek inclusief bloeddruk en miltgrootte in cm onder de ribbenboog;
- Echo milt: vaststellen exacte miltgrootte;
- Lab: (BB, diff, creat, Na+, K+, fosfaat, LDH, leverfuncties, urinezuur, glucoseprofiel, lipidenspectrum, PCR op BCR-ABL);
- Beenmergonderzoek: morfologie, flowcytometrie, moleculair (PCR op BCR/ABL) en cytogenetica. Bij dry-tap: PA;
- Berekening (prognostische risicoscores) ZOWEL Sokal, Euro als ELTS. Eventueel kan de EUTOS score berekend worden (zie kopje berekeningen op www.hematologiegroningen.nl).
Risico scores
| Risicogroep | Sokal score | Euro-/Hasford score | EUTOS score | ELTS score |
|---|---|---|---|---|
| Laag | < 0,8 | ≤ 780 | ≤ 87 | ≤ 1,5680 |
| Intermediair | 0,8-1,2 | 781-1480 | – | 1,5681-2,2185 |
| Hoog | > 1,2 | > 1480 | > 87 | > 2,2185 |
De Sokal score, de Euro-/Hasford score en de EUTOS score zijn een maat voor het risico op transformatie dan wel progressie van de CML. Het berekenen van de scores is met name van prognostisch belang. De uitkomst heeft echter geen invloed op de keuze van eerstelijnsbehandeling met TKI.
De ELTS score is gevalideerd voor de voorspelling van CML-gerelateerde dood in patiënten met CML in chronische fase die behandeld worden met TKI. De ELTS score verdient de voorkeur om te gebruiken indien standaard gestart wordt met imatinib als eerstelijns TKI.
Behandeling
Filter trials en protocollen voor dit ziektebeeldDe eerstelijnsbehandeling is voor alle patiënten in chronische fase imatinib 1 dd 400 mg.
Bij diagnose:
- Bij leukocyten ≥ 150 × 109/l te overwegen hydroxycarbamide en allopurinol;
- Preventie trombo-embolieën: carbasalaatcalcium indien trombocyten > 750 × 109/l zonder aanwijzingen voor hemorragische diathese;
- Leukaferese.
Beschikbare CML behandelingen*:
- 1e generatie TKI: imatinib 1 dd 400 mg;
- 2de generatie TKI: dasatinib 1 dd 100 mg, Nilotinib 2 dd 300 mg, Bosutinib 1 dd 500 mg;
- 3de generatie: ponatinib 1 dd 45 mg;
- STAMP-remmer: asciminib (alleen op basis van compensonate use) 2 dd 40 mg.
* Betreft startdoseringen bij normale nier- en leverfunctie, indien afwijkend dosis aanpassen aan de hand van FK.
Bij een de novo acceleratiefase gaat de voorkeur uit naar een tweede generatie TKI.
De richtlijn is niet geheel duidelijk over de indicatie voor een allogene stamceltransplantatie bij een acceleratiefase de novo. In het UMCG neigen wij hier wel toe wanneer hier sprake van is.
Bij een de novo CML in blastencrisis wordt gestart met dasatinib 1 dd 140 mg (al dan niet gecombineerd met chemotherapie). Bij het behalen van een complete remissie dient in principe overgegaan te worden tot een allogene stamceltransplantatie.
Bij bijwerkingen en/of therapiefalen wordt er geswitcht naar een volgende lijn. Bij het ontbreken van comorbiditeiten heeft dasatinib 1 dd 100 mg de voorkeur boven andere TKI’s.
Bij genoemde comorbiditeiten dient de TKI gekozen te worden conform onderstaande tabel:
| Comorbiditeit | Voorkeur voor TKI | Niet-gewenste TKI |
|---|---|---|
| Diabetes | dasatinib, bosutinib | nilotinib |
| Pulmonale aandoeningen of pulmonale hypertensie | bosutinib, nilotinib | dasatinib |
| Gastro-intestinale problemen | nilotinib, dasatinib | bosutinib |
| Cardiovasculaire aandoeningen | bosutinib | nilotinib, dasatinib, ponatinib |
| Perifeer/arterieel vaatlijden | bosutinib (dasatinib?) | nilotinib, ponatinib |
| Lever | dasatinib (nilotinib?) | bosutinib |
| Nier | nilotinib, dasatinib | bosutinib |
Responsbeoordeling
- PCR op BCR-ABL in perifeer bloed:
- In het eerste jaar iedere 3 maanden;
- Bij een aanhoudende MMR (meer dan 1 jaar minimaal MR4 (minimaal 3 metingen) iedere 4-6 maanden);
- Bij een responscategorie “suboptimale respons” of “therapiefalen” elke vier tot zes weken BCR-ABL bepaling (zie tabel hieronder (tabel is leidend)).
- Beenmergonderzoek (morfologie en cytogenetica) bij aanhoudende graad 3-4 hematologische toxiciteit, bij therapiefalen om progressie naar een acceleratiefase of blastencrisis uit te sluiten.
| Respons | |
|---|---|
| Hematologische respons | |
| Complete hematologische respons (CHR) | Trombocyten < 450 × 10⁹/l Leukocyten < 10 × 10⁹/l Differentiatie zonder immature granulocyten < 5% basofielen Milt niet palpabel |
| Cytogenetische respons | |
| Complete cytogetische respons (CCyR) | Geen Philadelphia chromosoom (Ph)+ metafasen |
| Partiële cytogenetische respons (PCyR) | 1-35% Ph+ metafasen |
| Minor cytogenetische respons (mCyR) | 36-65% Ph+ metafasen |
| Minimale cytogentische respons (minCyR) | 66-94% Ph+ metafasen |
| Geen cytogentische respons | ≥ 95% Ph+ metafasen |
| Moleculaire respons | Internationale schaal (IS) |
| MR1 | BCR-ABL ≤ 10% |
| MR2 = CCyR | BCR-ABL ≤ 1,0% |
| Majeure (‘Major’) moleculaire respons (MMR ; MR3) | BCR-ABL ≤ 0,1% |
| MR4 | BCR-ABL meetbaar ≤ 0,01% |
| MR4.5 | BCR-ABL meetbaar ≤ 0,0032% |
| MR5 | BCR-ABL meetbaar ≤ 0,001% |
Evaluatie van 1e-lijns TKI-therapie bij CML in chronische fase
| Evaluatiemoment | Uitkomst | Actie | |
|---|---|---|---|
| 3 maanden | Optimale respons: | CHR en Ph+ ≤ 35% en BCR-ABL1 ≤ 10% | 1e-lijns TKI continueren |
| Suboptimale respons: | BCR-ABL1 > 10% en/of Ph+ > 35 maar ≤ 95% |
Check compliance; spiegelbepaling; mutatie analyse. Evt. switch of ophogen dosering imatinib Intensiveer monitoring (1× per maand) Bij T315I-mutatie: ponatinib (allo-Tx wel exploreren). |
|
| Therapiefalen: | Geen CHR en/of Ph+ > 95% | Controleer compliance; spiegelbepaling; mutatieanalyse. Afhankelijk hiervan 2e-lijns TKI of Bij T315I-mutatie, er is geen bewijs dat allo-SCT superieur is aan ponatinib (allo-Tx wel exploreren). |
|
| 6 maanden | Optimale respons: | BCR-ABL1 < 1% en/of Ph+ 0% | Imatinib dosis continueren |
| Suboptimale respons: | BCR-ABL1 1-10% en/of Ph+ 1-35% | Controleer compliance; spiegelbepaling; mutatieanalyse. Afhankelijk hiervan: overweeg imatinib verhogen tot 800 mg; dan wel 2e-lijns TKI. Ponatinib bij T315I-mutatie (allo-Tx wel exploreren). |
|
| Therapiefalen: | BCR-ABL1 > 10% en/of Ph+ > 35% | Controleer compliance; spiegelbepaling; mutatieanalyse. Afhankelijk hiervan 2e-lijns TKI of ponatinib bij T315I-mutatie, er is geen bewijs dat allo-SCT superieur is aan ponatinib (allo-Tx wel exploreren). | |
| 12 maanden | Optimale respons: | BCR-ABL1 ≤ 0,1% | Medicatie continueren |
| Suboptimale respons: | BCR-ABL1 0,1-1% | Controleer compliance; controleer aanwezigheid klonale hematopoëse; spiegelbepaling; mutatieanalyse. Afhankelijk hiervan: overweeg imatinib verhogen tot 800 mg, dan wel 2e-lijn TKI. Ponatinib bij T315I-mutatie, er is geen bewijs dat allo-SCT superieur is aan Ponatinib; bij suboptimale respons > 12 maanden, dan overweeg allo-SCT. |
|
| Therapiefalen: | BCR-ABL1 > 1% en/of Ph > 0% | Controleer compliance; spiegelbepaling; mutatieanalyse. Afhankelijk hiervan 2e-lijns TKI of ponatinib bij T315I-mutatie, er is geen bewijs dat allo-SCT superieur is aan ponatinib; overweeg allo-SCT (allo-Tx wel exploreren). | |
| Daarna, onafhankelijk van tijdstip | Optimale respons | BCR-ABL1 ≤ 0,1% | Medicatie continueren |
| Suboptimale respons: | Klonale chromosomale afwijkingen in Ph+-cellen (-7 of 7q-) | Controleer compliance; spiegelbepaling; mutatieanalyse. Afhankelijk hiervan: overweeg imatinib verhogen tot 800 mg of 2e-lijns TKI. Ponatinib bij T315I-mutatie; bij suboptimale respons > 12 maanden, dan overweeg allo-SCT |
|
| Therapiefalen: | Verlies van CHR Verlies van CCR Verlies van MMR (in 2 opeenvolgende testen) Mutaties Additionele chromosomale afwijkingen in Ph+-cellen |
Controleer compliance; controleer aanwezigheid klonale hematopoëse; spiegelbepaling; mutatieanalyse. Afhankelijk hiervan 2e-lijns TKI of ponatinib bij T315I-mutatie, er is geen bewijs dat allo-SCT superieur is aan ponatinib; overweeg allo-SCT |
Responsevaluatie en beoordeling bij tweedelijnstherapie in geval van falen eerstelijns TKI
| Optimaal | Waarschuwing | Falen | |
|---|---|---|---|
| Uitgangssituatie | n.v.t. | Geen CHR of verlies van CHR op imatinib of niet bereiken van cytogenetische respons op eerstelijns TKI of hoog risico-Sokal/Euroscore | n.v.t. |
| 3 maanden | BCR-ABL ≤ 10% en/of Ph+ < 65% |
BCR-ABL > 10% en/of Ph+ 65-95% |
geen CHR of Ph+ > 95% of nieuwe mutaties |
| 6 maanden | BCR-ABL ≤ 10% en/of Ph+ < 35% |
Ph+ 35-65% | BCR-ABL > 10% en/of Ph+ > 65% en/of nieuwe mutaties |
| 12 maanden | BCR-ABL ≤ 1% en/of Ph+ 0% |
BCR-ABL 1-10% en/of Ph+ 1-35% |
BCR-ABL > 10% en/of Ph+ > 35% en/of nieuwe mutaties |
| Daarna elk moment | BCR-ABL ≤ 0,1% | CCA/Ph-(-7 pf 7q-) BCR-ABL > 0,1% |
Verlies van CHR of verlies van CCyR of PCR nieuwe mutaties bevestigd of verlies van MMR* of CCA/Ph+ |
| * In 2 opeenvolgende onderzoeken, waarvan 1 met een BCR-ABL niveau van ≥ 1% | |||
Therapiefalen
Overwegingen bij het niet behalen van een optimale respons:
- Therapietrouw uitvragen;
- Verminderde absorptie en/of interacties met comedicatie nagaan;
Mogelijke interacties:- Gebruik van CYP3A4-remmers (azol-antimycotica, erythromycine, claritromycine, grapefruit); kunnen een verhoging van de bloedspiegel van imatinib geven. Gebruik van CYP3A4-inductoren (dexamethason, anti-epileptica, rifampicine, H2-antagonisten, barbituraten, sint-janskruid) kunnen de bloedspiegel van imatinib verlagen;
- Absorptie: van imatinib, dasatinib, ponatinib en asciminib is de absorptie goed en niet afhankelijk van voedsel. Van nilotinib en bosutinib is de absorptie matig en voedsel-afhankelijk (inname met voedsel verhoogt de absorptie);
- Gebruik van paracetamol is wel toegestaan, mits volgens voorschrift arts/VS wordt gebruikt;
- Gebruik van protonpomp inhibitors (PPI) is toegestaan bij imatinib en ponatinib en in veel gevallen ook bij nilotinib. Bij gebruik van bosutinib of dasatinib in combinatie met PPI dient men extra alert te zijn, indien de PPI toch is geïndiceerd dan kan de TKI het beste 2 uur voor inname van de PPI worden ingenomen (mits 1 dd PPI);
- Imatinib is een remmer van CYP3A4 en CYP2D6 en kan de werking van bijvoorbeeld ciclosporine A, metoprolol, statines en orale anticoagulantia beïnvloeden;
- Bij patiënten die levothyroxine gebruiken moet zes weken na start van imatinib de schildklierfunctie worden gecontroleerd, dosering levothyroxine op geleide van TSH;
- Voorzichtigheid is geboden bij decompensatio cordis en bij gebruik van antiarrhythmica wegens mogelijke QTc-verlenging.
| Afnamemoment | Streefwaarde (µg/l) | |
|---|---|---|
| Imatinib | Vlak voor de volgende gift | ⇒ 1000 |
| Nilotinib | Vlak voor de volgende gift | 829-1500 |
| Dasatinib | Vlak voor de volgende gift (t.b.v. toxiciteit) | 1,4-3,4 |
| 2 uur na de gift (t.b.v. effectiviteit) | ⇒ 50 | |
| Ponatinib | Vlak voor de volgende gift | Geen targetwaarde m.b.t. effectiviteit, populatiegemiddelde |
| Bosutinib | Vlak voor de volgende gift | Geen targetwaarde m.b.t. effectiviteit, populatiegemiddelde |
Bij sub-therapeutische spiegel:
-
- Imatinib verhogen (voorkeur boven switchen naar 2G-TKI);
- Bij gebruik van een tweede/derde generatie TKI dosis verhogen in overleg met T. Oude-Munnink (ziekenhuisapotheker);
- Bij aanhoudend probleem switchen naar een andere TKI.
Bij therapeutische spiegels dient de TKI bij falen van de behandeling direct te worden vervangen door een ander middel. Overschakelen naar een hoger klasse TKI is het meest kansrijk; - Overschakeling tussen 2G-TKI dient alleen te geschieden als er een mutatie aantoonbaar is waarbij de alternatieve 2G-TKI wel activiteit zou moeten hebben;
- Bij patiënten met een T315I-mutatie die falen op een 2G-TKI dient ponatinib 1 dd 45 mg gegeven te worden in combinatie met Ascal 80 mg. Bij patiënten met een verhoogd CVR kan een startdosis van 1 dd 30 mg overwogen te worden.
- Mutatieanalyse
Bij therapiefalen onder adequate spiegels dient mutatieanalyse verricht te worden. Dit kan via Epic op de volgende wijze worden aangevraagd: (flowcytometrie CML).
Bij aangetoonde mutaties en therapiefalen op een derde-lijstmiddel dient de patiënt te worden besproken in de tumorwerkgroep, ook met het oog op een eventuele allogene stamceltransplantatie.
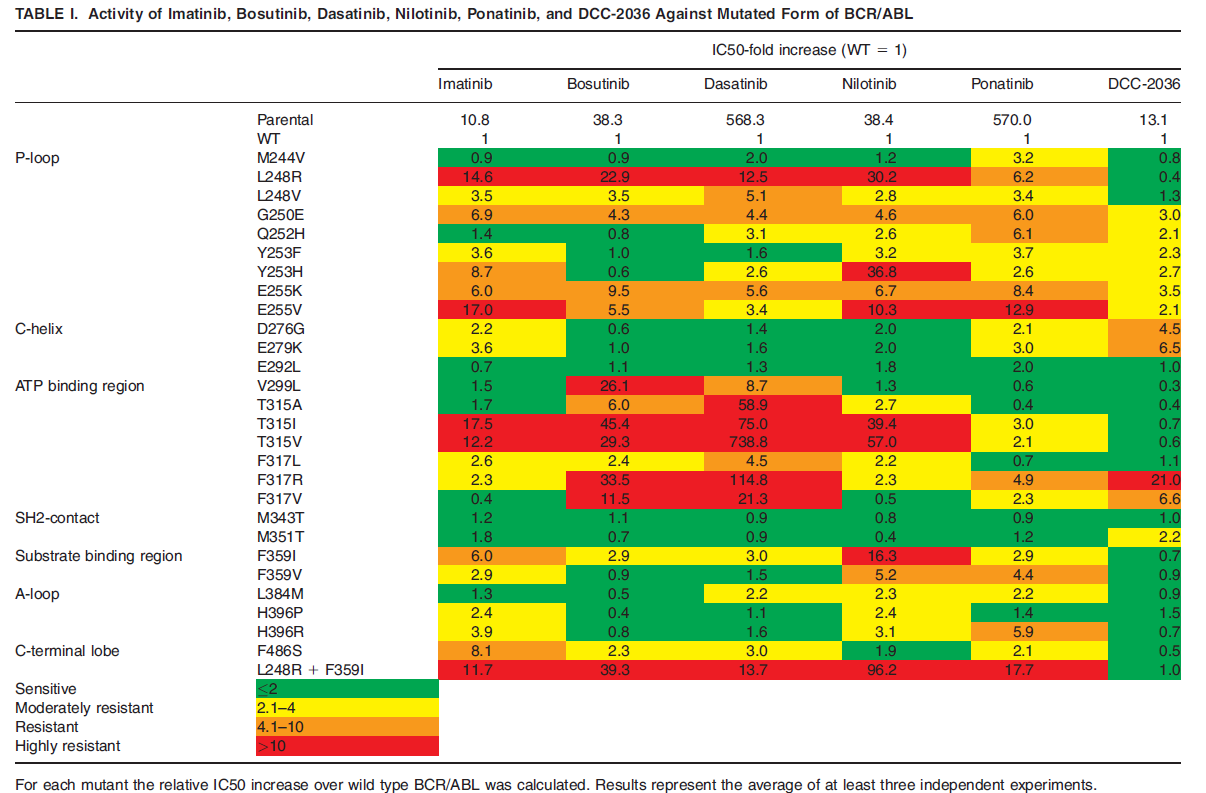 |
|---|
Additionele cytogenetische afwijking:
- In de Phi-clone: is per definitie acceleratiefase;
- Buiten de Phi-clone: maatwerk, patiënt dient besproken te worden in de tumorwerkgroep.
Bijzondere omstandigheden:
- Acceleratiefase (> 15% blasten):
- Acceleratiefase tijdens de behandeling met TKI: BCR-ABL mutatieanalyse. Indien mutatie gevonden wordt die gevoelig is voor een niet eerder gegeven middel, dan dient hiermee gestart te worden. Zorgvuldige monitoring (elke 4-6 weken) tot een optimale respons is bereikt. Bij uitblijven van acceptabele respons: allo-SCT.
Acceleratiefase onder behandeling met tweede generatie TKI’s: wanneer geen richtinggevende mutatie gevonden wordt, moet ponatinib worden gegeven en een donorsearch gestart worden (allo-SCT), bij uitblijven van een acceptabele respons. - Blastencrisis (> 30% blasten):
- Bij patiënten die een blastencrisis ontwikkelen tijdens TKI-behandeling dient in afwachting van de resultaten van mutatieanalyse een volgende generatie TKI gegeven te worden. De doseringen zijn als volgt:
- Dasatinib 1 dd 140 mg
- Bosutinib 1 dd 500 mg
- Ponatinib 1 dd 45 mg
- Bij het bereiken van een CHR, uitvoeren van een allo-SCT (vervolg: zie volgend punt).
- Bij patiënten die een blastencrisis ontwikkelen tijdens TKI-behandeling dient in afwachting van de resultaten van mutatieanalyse een volgende generatie TKI gegeven te worden. De doseringen zijn als volgt:
- Patiënten na allogene stamceltransplantatie:
Patiënten die een allogene stamceltransplantatie hebben ondergaan voor een CML blastencrisis die eerder gevoelig bleek voor een al dan niet mutatie-gerichte TKI, dienen deze gedurende tenminste een jaar na de transplantatie voort te zetten waarbij het BCR-ABL niveau minstens een jaar lang niet-detecteerbaar moet zijn geweest.
- Acceleratiefase tijdens de behandeling met TKI: BCR-ABL mutatieanalyse. Indien mutatie gevonden wordt die gevoelig is voor een niet eerder gegeven middel, dan dient hiermee gestart te worden. Zorgvuldige monitoring (elke 4-6 weken) tot een optimale respons is bereikt. Bij uitblijven van acceptabele respons: allo-SCT.
Stoppen TKI
Onder de volgende voorwaarden kan een stoppoging met TKI worden overwogen:
- De CML was bij diagnose in chronische fase;
- De behandeling is nooit geswitcht vanwege gebrek aan respons. Verandering wegens tolerantie/bijwerkingen is wel toegestaan;
- De ziekte is tenminste 3 jaar, maar bij voorkeur 6 jaar, behandeld met een TKI;
- De ziekte is minimaal in MR4 (BCR-ABL < 0,01%) gedurende tenminste één, maar bij voorkeur 3 jaar;
- Het BCR-ABL niveau is in het laatste jaar minimaal 4 maal gemeten;
- Follow-up na staken:
- eerste half jaar elke 4 weken,
- tweede half jaar elke 6 weken;
- 2e en 3e jaar elke 3 maanden;
- 4e jaar elke 4 maanden;
- Vanaf het 5e jaar elke 6 maanden.
Wat te doen bij een niet-succesvolle stoppoging:
- Hervatting van therapie is geïndiceerd bij een verlies van MMR, dat wil zeggen een stijging van het BCR-ABL signaal tot > 0,1%;
- Buiten studieverband is er geen plaats voor een tweede stoppoging;
- Patiënten moeten voor het staken van de behandeling geïnformeerd worden over het TKI-onthoudingssyndroom.
- Symptomatische behandeling middels paracetamol en NSAID’s;
- Steroïden: prednison 1 week 30 mg, 1 week 20 mg, 1 week 10 mg, 1 week 5 mg en daarna stop;
- Lage dosis TKI hervatten: patiënt bespreken in het myeloid-overleg.
Zwangerschap(swens) en ouderschap
Zwangerschapswens tijdens behandeling voor CML:
- Mannelijke CML-patiënten hoeven hun TKI-behandeling niet te onderbreken als de vrouw zwanger wenst te raken;
- Vrouwelijke CML-patiënten dienen adequaat geïnformeerd te worden over het vermijden van zwangerschap tijdens gebruik van TKI’s. In het bijzonder in de eerste 12 weken van de zwangerschap is er een verhoogde kans op teratogeniciteit.
Vrouwelijke patiënten die al twee jaar een major of complete moleculaire respons hebben zouden de TKI kunnen staken om deze na de zwangerschap te hervatten. Vanzelfsprekend is frequent monitoren (maandelijks) van het BCR-ABL1 signaal noodzakelijk. Wanneer er tijdens de zwangerschap opnieuw een behandelindicatie aanwezig is (stijging van het BCR-ABL signaal boven de 1%), zijn de volgende opties mogelijk:
- Leukaferese (gehele zwangerschap);
- Peginterferon-alfa (gehele zwangerschap);
- Hydroxycarbamide (2e of 3e trimester);
- Nilotinib (zo laat mogelijk in de zwangerschap).
Zwanger en nieuwe diagnose CML
Indien er bij een al bestaande zwangerschap de diagnose CML wordt gesteld, is therapeutische leukaferese een goede behandeling. Afhankelijk van het stadium van de zwangerschap en het resultaat kan eventueel interferon toegevoegd worden. Hydroxycarbamide lijkt niet veilig gedurende het eerste trimester (intra-uteriene vruchtdood en congenitale afwijkingen). Tijdens het tweede en derde trimester is er een verhoogd risico op pre-eclampsie. Als al deze behandelingsvormen niet tot ziektecontrole leiden, kan nilotinib overwogen worden, mits zo laat mogelijk in de zwangerschap.
Bij een trombocytose dient acetylsalicylzuur of een LMWH gegeven te worden.
Bijwerkingen
Hematologische toxiciteit
- Bij een graad 3 of 4 hematologische toxiciteit (ANC < 1.0 × 109/l; trombocyten < 50 × 109/l) moet de behandeling (tijdelijk) onderbroken worden, soms is maatwerk noodzakelijk (ook bij toxiciteit en/of dosisreductie kan spiegelbepaling ook zinvol zijn). Nadien kan de behandeling veelal in volledige dosering hervat worden, mits (ANC > 1,5 × 109/l en trombocyten > 75 × 109/l). Zo niet zijn dosisverlagingen zoals onder beschreven een optie:
- Imatinib 1 dd 300 mg;
- Nilotinib 1 dd 300 mg;
- Dasatinib 1 dd 50 mg;
- Bosutinib 1 dd 300 mg;
- Ponatinib 1 dd 15 mg.
- Bij aanhoudende anemie kan erytropoëtine gegeven worden en bij aanhoudende neutropenie filgrastim;
- Allogene stamceltransplantatie dient overwogen te worden bij patiënten die door diepe cytopenieën niet adequaat behandeld kunnen worden.
Niet-hematologische toxiciteit
Algemeen veelvoorkomende niet-hematologische bijwerkingen:
- Elektrolytstoornissen;
- Rash;
- Vermoeidheid.
Veelvoorkomende bijwerkingen per middel:
- Imatinib: (periorbitaal)oedeem, vochtretentie, spierkrampen, hypofosfatemie, misselijkheid, hepatotoxiciteit;
- Nilotinib: arteriële vasculaire events, hyperglycaemie, QT-verlenging, verhoogde pancreasenzymen, hepatotoxiciteit, huiduitslag, haarverlies;
- Dasatinib: gastro-intestinale klachten, pleurale/pericardiale effusie, pulmonale hypertensie, verhoogde bloedingsneiging;
- Bosutinib: misselijkheid, diarree, verhoogde pancreasenzymen, hepatotoxiciteit;
- Ponatinib: arteriële vasculaire events, hypertensie, verhoogde pancreasenzymen, oculaire toxiciteit, droge huid.
Specifieke adviezen
- Bij spierkrampen: suppletie van calcium- of magnesiumzouten, kinine bevattende dranken of spiroflor;
- Bij een hypofosfatemie: vitamine D-deficiëntie uitsluiten;
- Bij dyspnoe: aanwezigheid van pleuravocht en pulmonale hypertensie;
- Om de kans op diarree door bosutinib te verminderen kan gestart worden met een lagere dosis (200-300 mg) om vervolgens geleidelijk te verhogen naar de maximale dosering van 1 dd 400 mg;
- Bij bosutinib moeten de gehaltes van transaminases, vooral in de eerste 3 maanden, maandelijks gecontroleerd worden.
Cardiovasculaire screening
- Belang van het stoppen met roken wordt benadrukt.
- Betreffende alle CML-patiënten:
- Bij diagnose: tensiecontrole, glucose en lipidenspectrum
- Na 3 maanden: tensie, glucose en lipidenspectrum
- Alle patiënten worden 1 × per jaar uitgebreid gescreend door VS (met o.a. RR, glucose en lipidenspectrum).
- Patiënten die een 2G-TKI gebruiken worden na 1 jaar verwezen naar de vasculaire geneeskunde voor eenmalige cardiovasculaire screening.
- Alle patiënten die worden behandeld met ponatinib of nilotinib worden jaarlijks verwezen naar de interne geneeskunde voor een enkel-armindex ter vroegtijdige diagnostiek van stenoses in de beenarteriën. Bij een enkel-armindex van ≤ 0,90 dient indien mogelijk de behandeling met ponatinib of nilotinib gestaakt te worden.
Lichamelijk onderzoek
- Systolische bloeddruk;
- BMI;
- Volledig LO.
Streefwaarden CVRM-screening
- SBD ≤ 140 mmHg;
- LDL-cholesterol ≤ 2,5 mmol/l;
- HbA1c bij geen DM 20-42 mmol/mol;
- HbA1c bij DM ≤ 53 mmol/mol;
- Glucose (niet nuchter) < 11,1 mmol/l;
- Triglyceriden ≤ 2,2 mmol/l;
- BMI: ≤ 70 jaar: BMI 20-25 kg/m2 en > 70 jaar: BMI 22-28 kg/m2
- Roken: niet;
- Alcohol: max. 1 glas/dag.
Behandeling cardiovasculaire risicofactoren
Niet-medicamenteus
- niet roken en meeroken vermijden, evt. verwijzen naar de Stoppen met roken-poli of begeleiding via de HA;
- voldoende bewegen: tenminste 150 minuten per week matig intensieve inspanning, zoals wandelen en fietsen, verspreid over diverse dagen; niet meer dan 8 uur per dag zitten, evt. verwijzen voor oncologische revalidatie;
- streven naar een optimaal gewicht: ≤ 70 jaar: BMI 20-25 kg/m2 en > 70 jaar: BMI 22-28 kg/m2, evt. met behulp van een diëtiste;
- gezond eten volgens de Schijf van Vijf van het Voedingscentrum, evt. advies van een diëtiste;
- stress voorkomen, evt. verwijzing psycholoog of maatschappelijk werk.
Medicamenteus
Bloeddruk:
(na 24-uurs bloeddrukmeting of bij SBD > 180 mmHg)
- Bij personen < 70 jaar zonder comorbiditeit: start ACE-remmer (bv. enalapril 1 dd 5 mg).
- Bij personen > 70 jaar of patiënten met DM: start calciumantagonist (bv. amlodipine 1 dd 5 mg). Cave: oedeem! (bij oedeem overweeg carnidipine).
LDL-cholesterol streefwaarde < 2,5 mmol/l:
- Start met rosuvastatine 1 dd 5 mg, na 3 maanden controleren → indien noodzakelijk kan de dosis opgehoogd worden naar max. 1 dd 20 mg;
- Bij bijwerkingen kan er geswitcht worden naar atorvastatine 1 dd 10 mg.
Diabetes:
- Verhoogd glucose (nuchter: ≥ 7,0 en niet nuchter ≥ 11,0): start metformine 2-3 dd 500 mg
- Na 14 dagen controle, evt. dosis aanpassen tot max. 2000 mg per dag
- Indien niet gewenste resultaat voeg Gliclazide 1 dd 30 mg (bij het ontbijt) toe, bij onvoldoende glycemische controle dosering stapsgewijs (elke 2-4 weken) verhogen met 30 mg/dag tot max. 1 dd 120 mg (cave hypoglycaemie).
Overweeg verwijzing voor insulinetherapie.
Literatuurlijst
- Hochhaus, A., Baccarani, M., Silver, R. T., Schiffer, C., Apperley, J. F., Cervantes, F., Clark, R. E., Cortes, J. E., Deininger, M. W., Guilhot, F., Hjorth-Hansen, H., Hughes, T. P., Janssen, J. J. W. M., Kantarjian, H. M., Kim, D. W., Larson, R. A., Lipton, J. H., Mahon, F. X., Mayer, J., … Hehlmann, R. (2020). European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia, 34(4), 966–984. https://doi.org/10.1038/s41375-020-0776-2
- Janssen, J. J. W. M., te Boekhorst, P. A. W., Posthuma, E. F. M., Klein, S. K., Hoogendoorn, M., de Waa l, T. T., Falkenburg, J. H. F., Biemond, B. J., van der Reijden, B., Bos, G. M. J., Petersen, E. J., Blijlevens, N., Smit, W. M., Verhoef, G. E. G., Vellenga, E., Thielen, N., Cornelissen, J. J., Ossenkoppele, G. J., & Westerweel, P. E. (2018). Achtergronden bij de richtlijn voor de behandeling van chronische myeloïde leukemie anno 2018 Deel 3: Stoppen van de behandeling, beleid bij zwangerschap, studies en therapie-aanbevelingen. Nederlands Tijdschrift voor Hematologie, 15, 326–335. https://www.ariez.nl/wp-content/uploads/2018/10/NTVH7_2018_Art._Janssen_CML_deel3.pdf
- Nederlandse Vereniging voor Hematologie(NVvH). (2018, juni). 1Versie 14-04-2018RICHTLIJN ChronischeMyeloïde Leukemie (Versie 14-04-2018). https://hematologienederland.nl/wp-content/uploads/2019/07/hovon-cml-richtlijn-14-04-2018_geautoriseerd.pdf
- Nicolini, F. E., Basak, G. W., Kim, D.-W., Olavarria, E., Pinilla-Ibarz, J., Apperley, J. F., Hughes, T., Niederwieser, D., Mauro, M. J., Chuah, C., Hochhaus, A., Martinelli, G., DerSarkissian, M., Duh, M. S., McGarry, L. J., Kantarjian, H. M., & Cortes, J. E. (2017). Overall survival with ponatinib versus allogeneic stem cell transplantation in Philadelphia chromosome-positive leukemias with the T315I mutation. Cancer, 123(15), 2875–2880. https://doi.org/10.1002/cncr.30558
- Redaelli, S., Mologni, L., Rostagno, R., Piazza, R., Magistroni, V., Ceccon, M., Viltadi, M., Flynn, D., & Gambacorti-Passerini, C. (2012). Three novel patient-derived BCR/ABL mutants show different sensitivity to second and third generation tyrosine kinase inhibitors. American Journal of Hematology, 87(11), E125–E128. https://doi.org/10.1002/ajh.23338




