Eerstelijnstherapie
Filter trials en protocollen voor dit ziektebeeldB-ALL en T-ALL
Binnen protocol
Indien studie geopend is heeft het de uitdrukkelijke voorkeur patiënt te behandelen binnen de klinische studie.
B-ALL: eerste lijn: H146 (blinatumomab + chemotherapie) volgt.
Buiten protocol
Patiënten ≥ 18 jaar die fit worden bevonden voor intensieve chemotherapie: behandeling volgens controle-arm van de H100. De leeftijdsindelingen zoals gedefinieerd in het H100-protocol (i.e. ≤ 40 jaar en > 40 jaar) worden hierbij gehandhaafd.
Indien positief voor het Philadelphia-chromosoom (Phi+), dan: dasatinib 1 dd 100 mg toevoegen. Dasatinib heeft voorkeur vanwege vermogen door te dringen in CNS. Bij intolerantie, andere TKI.
NB Gedurende de hele behandeling TKI toevoegen, behalve tijdens asparaginasebehandeling.
Patiënten met standaard risico: geen allo-HCT in eerste lijn.
Patiënten met hoog risico: allo-HCT in eerste lijn.
Patiënten ≥ 18 jaar die niet fit worden bevonden voor intensieve chemotherapie, kunnen meestal langdurig (jaren) in remissie worden gehouden met pre-inductie volgens Groninger schema gevolgd door onderhoudsbehandeling volgens het Groninger schema.
Als Phi+ B-ALL: dasatinib 1 dd 100 mg toevoegen.
Patiënten met hyperleukocytose (> 100 × 109/l) bij presentatie:
Geen hyperviscositeit: pre-inductie volgens het Groninger protocol gevolgd door behandeling volgens H100 (hoog risico). Als patiënten geen pre-inductie kunnen krijgen, prednison 1 dd 60 mg oraal × 7 dagen.
Lymfoblastair lymfoom met mediastinale massa en/of lymfadenopathie elders
Patiënten met lymfoblastair lymfoom (LBL) worden behandeld als ALL; indien mogelijk in het vigerende protocol, anders volgens de gedefinieerde standaardbehandeling.
Responsevaluatie LBL:
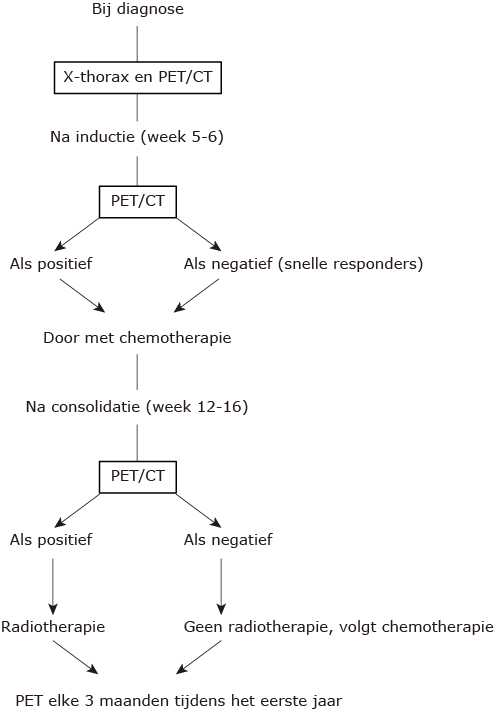
Wanneer radiotherapie (RT)?
- patiënten die geen allogene SCT krijgen: RT voor de maintenance.
- patiënten die een allogene SCT krijgen met gereduceerde conditionering: RT voor de conditionering.
- patiënten die een allogene SCT krijgen met myeloablative conditionering met TBI (12 Gy): TBI van de conditionering is voldoende.
Schema folinezuur en HD MTX
| Tijd na einde MTX | MTX-spiegel (µg/l) | Folinezuur dosering |
|---|---|---|
| 12 h (dag 2, 36h na start) | < 4.500 | 30 mg elke 6h IV na 2× gevolgd door p.o. |
| 4.500-45.000 | 100 mg/m2 elke 6h i.v. | |
| > 45.000* | 1000 mg/m2 elke 6h i.v. | |
| 24 h (dag 3, 48h na start) | < 100 | 30 mg elke 6h p.o.** tot spiegel < 15 µg/l |
| 100-450 | 30 mg elke 6h i.v. | |
| 450-900 | 100 mg/m2 elke 6h i.v. | |
| 900-4.500 | 200 mg/m2 elke 6h i.v. | |
| > 4.500* | 200 mg/m2 elke 3h i.v. | |
| 48 h (dag 4, 72h na start) | < 15 | folinezuur stop |
| 15-45 | 15 mg elke 6h p.o.** tot spiegel < 15 µg/l | |
| 45-100 | 30 mg elke 6h p.o.** tot spiegel < 15 µg/l | |
| 100-450 | 200 mg/m2 elke 6h i.v. | |
| 450-4.500 | 200 mg/m2 elke 3h i.v. | |
| > 4.500* | 500 mg/m2 elke 3h i.v. | |
| 72 h (en verder) | > 45 | Continueren folinezuur tot < 15 µg/l en eventueel overleg apotheek |
| * Bij zeer hoge MTX-spiegels, vertraagde MTX-klaring, ernstige toxiciteit en/of creatininestijging kan glucarpidase overwogen worden. ** Bij patiënten met malabsorptiesyndromen en/of gastro-intestinale stoornissen waarbij de darmresorptie van folinezuur niet gewaarborgd is, dient de toediening i.v. te blijven. |
||
Allogene stamceltransplantatie
Indicaties:
- Patiënten in CR1: alle hoogrisicopatiënten (zie boven)
- Patiënten in CR2: alle patiënten
Conditionering:
- Keus voor type conditionering: zie allo-HCT paragraaf
- Voor ALL is het belangrijk te kiezen voor conditionering met RT. Een uitzondering kan de haplo-identieke stamceltransplantatie zijn.
- Patiënten met CZS-betrokkenheid:
- bij myeloablatieve conditionering (12 Gy TBI): geen CZS-behandeling na allo-HCT.
- bij RIC-conditionering: na allo-HCT nog CZS-behandeling met cytarabine 100 mg op dag +28, +56, +84.
- Patiënten met B-ALL phi + :
- bij primaire phi+ B-ALL en snelle moleculair respons (na inductie): TKI tot +1 jaar na allo-SCT.
- bij primaire phi+ B-ALL en trage moleculair respons: er is geen consensus. Advies: TKI minimaal tot +1 jaar na allo-SCT en aanpassen afhankelijk van respons.
- bij lymfatische blastencrise: er is geen consensus. Advies: TKI levenslang na allo-SCT.
Recidief/Refractair ALL
- Controleer of er studies lopend zijn in Nederland die voor patiënt, gezien moleculaire afwijkingen van ziekte, relevant kunnen zijn; anders volgens algoritmes zoals hieronder besproken.
NB Prognose van ALL die niet reageert op of recidiveert na intensieve remissie-inductie is zeer somber met klassieke intensieve chemotherapie (mediane overleving 4,5-8,4 maanden). - Het geven van anthracyclines is vaak beperkt t.g.v. bereiken van maximaal toegestane cumulatieve dosering. Meestal is er nog ruimte voor één anthracycline-bevattende kuur.
- Bij recidief Philadelphia+ B-ALL, screening voor mutaties in TKI binding pocket.
| Type patiënt | Eerste keuze | Alternatief c.q. vervolg |
| R/R B-ALL (Phi neg), fitte patiënten | Eerste cyclus anti-CD22-calicheamicine (inotuzumab ozogamicin).
Tweede cyclus: blinatumomab gevolgd door een allo-SCT |
Re-inductie met Hyper-CVAD deel B (HD-MTX/HD-ARA-C) als tumorreductie gevolgd door: Blinatumomab: eerste cyclus: eerste week 9 µg/dag gevolgd door 28 µg/dag × 3 weken 2 weken rust + conventionele CZS profylaxe. Blinatumomab tweede cyclus: 28 µg/dag × 4 weken + CZS profylaxe. CAR T-cells in studieverband. Als patiënten in complete remissie komen: allo-SCT |
| R/R B-ALL, Phi neg, geen fitte patiënten (geen kandidaten allo-SCT) | Eerste cyclus anti-CD22-calicheamicine (inotuzumab ozogamicin).
Tweede cyclus: blinatumomab Volgende cycli: × 3 cycli consolidatie met blinatumomab |
Re-inductie met pre-inductie volgens Groninger schema als tumor reductie gevolgd door:
Blinatumomab eerste cyclus: eerste week 9 µg/dag gevolgd door 28 µg/dag × 3 weken 2 weken rust + conventionele CZS prof/behandeling. Blinatumomab tweede cyclus: 28 µg/dag × 4 weken + CZS pfx Als patiënten in complete remissie komen: overwegen consolideren met 3 cycli blinatumomab + CZS pfx of door met maintenancekuur (individualiseren). CAR T-cells in studieverband |
| R/R B-ALL Phi positief, fitte patiënten | Idem als Phi neg als de blinatumomab geregistreerd is voor Phi positief B-ALL | Inozutumab ozogamicin × 2 cycli gevolgd door allo-SCT
HAM schema gevolgd door allo-SCT CAR T-cells in studieverband |
| R/R B-ALL Phi positief, niet fitte patiënten | Idem als Phi neg als de blinatumomab geregistreerd is voor Phi positief B-ALL. Anders:
Inozutumab ozogamicin × 2 cycli gevolgd door TKI-remmer (dasatinib) |
Re-inductie met pre-inductie volgens Groninger schema als tumorreductie + TKI-remmer (dasatinib) gevolgd door maintenance volgens Groninger schema
CAR T-cells in studieverband |
| R/R T-ALL fitte patiënten zonder CZS-lokalisatie | T-ALL < 20 jaar: Nelarabine (AraG) 650 mg/m2/d × 5 dagen, etoposide 100 mg/m2/d × 5 dagen, inlooptijd 2 uur en cyclofosfamide 440 mg/m2/d × 5 dagen, inlooptijd 30-60 min (Berg SL et al. 2005) (2). Bij remissie, allo-SCT. T-ALL ≥ 20 jaar: Nelarabine monotherapie 1,5 g/m2 op dag 1,3 en 5 (7): 1 of 2 cycli, bij remissie, allo-SCT. |
Anti-CD30 (brentuximab) als de T-ALL blasten CD30 positief zijn gevolgd door allo-SCT
HAM schema gevolgd door allo-SCT |
| R/R T-ALL fitte patiënten met CZS-lokalisatie | Nelarabine (AraG) 400 mg/m2/d × 5 dagen, etoposide 100 mg/m2/d × 5 dagen, inlooptijd 2 uur en cyclofosfamide 440 mg/m2/d × 5 dagen, inlooptijd 30-60 min (Berg SL et al 2005). (2) Bij remissie, allo-SCT. | Hyper-CVAD deel B gevolgd door allo-SCT |
| R/R T-ALL niet fitte patiënten met CZS-lokalisatie | Nelarabine palliatief gevolgd of niet door anti-CD30 |
Toxiciteit van blinatumumab en behandeling
Literatuurlijst
- Bassan R, Maino E, Cortelazzo S. Lymphoblastic lymphoma: an updated review on biology, diagnosis, and treatment. Eur J Haematol. 2016;96:447-60.
- Commander, L.A., Seif, S.A., Insogna, I.G., Rheingold, S.R. Salvage therapy with nelarabine, etop0side, and cyclophosphamide in relapsed/refractory paediatric T-cell lymphoblastic leukaemia and lymphoma. Brit H Haematol 2010, 150, 345-51.
- Cortelazzo S, Intermesoli T, Oldani E, et al. Results of a lymphoblastic leukemia-like chemotherapy program with risk-adapted mediastinal irradiation and stem cell transplantation for adult patients with lymphoblastic lymphoma. Ann Hematol. 2012;91:73-82.
- Daenen, S., Imhoff, G.W. van, Berg, E. van den, et al. Improved outcome of adult acute lymphoblastic leukaemia by moderately intensified chemotherapy which includes a ‘pre-induction’ course for rapid tumour reduction: preliminary results on 66 patients. Brit J Haematol 1998, 100, 273-82.
- Daenen, S., van Imhoff, G.W., de Wolf, J.T., Vellenga, E., Berg- Ruiter, E. van den, Kluin-Nelemans, H.C. A ‘pre-induction course’ with non-cross-reacting cytostatic drugs for rapid tumour load reduction improves outcome in adult acute lymphoblastic leukaemia. Br J Haematol. 2007,138, 275-7.
- Daenen S, van der Holt B, Dekker AW, et al. Intensive chemotherapy to improve outcome for patients with acute lymphoblastic leukemia over the age of 40: a phase II study for efficacy and feasibility by HOVON. Leukemia 2012;26:1726-9.
- Gokbuget, N., Basara, N., Baurmann, H., et al. High single-drug activity of nelarabine in relapsed T-lymphoblastic leukemia/lymphoma offers curative option with subsequent stem cell transplantation. Blood 2011, 118, 3514-9.
- Gökbuget N, Zugmaier G, Klinger M, et al. Long-term relapse-free survival in a phase 2 study of blinatumomab for the treatment of patients with minimal residual disease in B-lineage acute lymphoblastic leukemia. Haematologica. 2017;102:e132-e135
- Hijiya, N., Thomson, B., Isakoff, M.S., et al. Phase 2 trial of clofarabine in combination with etoposide and cyclophosphamide in pediatric patients with refractory or relapsed acute lymphoblastic leukemia. Blood 2011, 118, 6043-9.
- Hoelzer D, Bassan R, Dombret H, Fielding A, Ribera JM, Buske C. ESMO Guidelines Committee. Acute lymphoblastic leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016;27(suppl 5):v69-v82.
- Kantarjian H, Stein A, Gökbuget N, et al. Blinatumomab versus Chemotherapy for Advanced Acute Lymphoblastic Leukemia. N Engl J Med. 2017;376:836-847
- Lepretre S, Touzart A, Vermeulin T, et al. Pediatric-Like Acute Lymphoblastic Leukemia Therapy in Adults With Lymphoblastic Lymphoma: The GRAALL-LYSA LL03 Study. J Clin Oncol. 2016;34:572-80.
- Martinelli G, Boissel N, Chevallier P, et al. Complete Hematologic and Molecular Response in Adult Patients With Relapsed/Refractory Philadelphia Chromosome-Positive B-Precursor Acute Lymphoblastic Leukemia Following Treatment With Blinatumomab: Results From a Phase II, Single-Arm, Multicenter Study.J Clin Oncol. 2017 Mar 29:JCO2016693531.
- Topp MS, Kufer P, Gökbuget N, et al. Targeted therapy with the T-cell-engaging antibody blinatumomab of chemotherapy-refractory minimal residual disease in B-lineage acute lymphoblastic leukemia patients results in high response rate and prolonged leukemia-free survival. J Clin Oncol. 2011;29:2493-8.
- Topp MS, Gökbuget N, Stein AS, et al.Safety and activity of blinatumomab for adult patients with relapsed or refractory B-precursor acute lymphoblastic leukaemia: a multicentre, single-arm, phase 2 study. Lancet Oncol. 2015;16:57-66.




