Oorsprong van de ziekte en symptomen
Chronisch myeloïde leukemie (CML) is een kwaadaardige ziekte van het bloed waarbij een toename is opgetreden van vooral de witte bloedcellen, maar ook de andere cellijnen kunnen bij dit ziektebeeld betrokken zijn. De oorzaak van CML is niet bekend, behalve dat er in zeldzame gevallen een relatie met hoge dosis radioactieve straling is gevonden. Na de atoombommen op Japan is namelijk een toename van CML waargenomen.
Het is een zeer zeldzame vorm van leukemie. In Nederland wordt de diagnose bij circa 200 tot 250 nieuwe patiënten gesteld, dat wil zeggen bij 14 per 1 miljoen inwoners. De gemiddelde leeftijd van de patiënten is zo’n 50 tot 60 jaar. CML kan echter ook op jongere leeftijd voorkomen, zelfs in zeldzame gevallen al op de kinderleeftijd (dia 2).

Dia 1
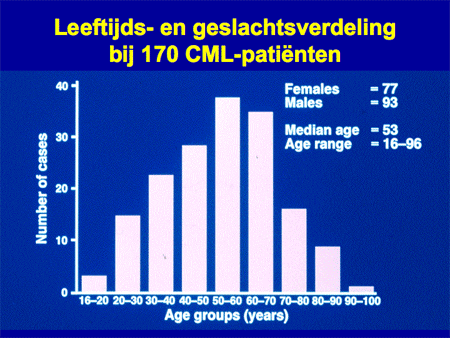
Dia 2
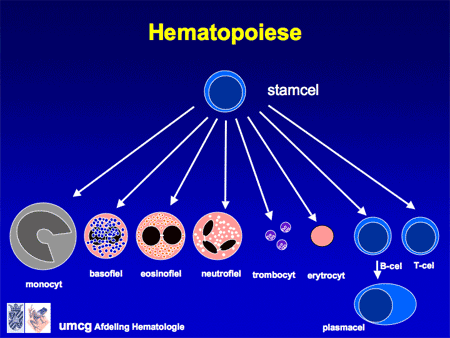
CML ontstaat in het beenmerg (zie ook Beenmergonderzoek). Het beenmerg is de plaats waar de normale bloedaanmaak plaatsvindt, zoals de rode cellen (nodig voor zuurstoftransport; een tekort geeft bloedarmoede), witte cellen (leukocyten genaamd, een hele diversiteit aan soorten, en nodig voor de afweer tegen bacteriën, virussen en andere infectiebronnen) en bloedplaatjes (trombocyten genaamd, nodig voor de bloedstolling).
In het geval van CML is ergens in de vroegste stamcel een fout opgetreden waardoor de cellen harder en vaker gaan delen, maar wel blijven uitrijpen. Het resultaat is een toename van vooral de witte cellen, zowel in het bloed als in het beenmerg, met daarbij vaak ook een toename van de bloedplaatjes. Soms is het aantal cellen zo sterk toegenomen dat een buis bloed die is blijven staan, wit wordt. Daarvandaan komt ook de naam leukemie (letterlijk vertaald ‘wit bloed’). Naarmate het aantal cellen toeneemt, zal ook de milt gaan opzetten. De miltvergroting kan leiden tot een zwaar of pijnlijk gevoel links in de bovenbuik (dia 5).

Dia 3

Dia 4
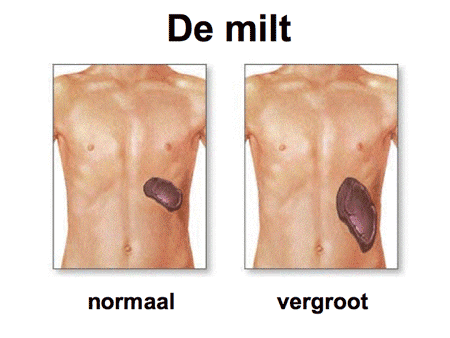
Dia 5
Het bijzondere van het ziektebeeld is dat de toegenomen witte bloedcellen en bloedplaatjes wel normaal blijven functioneren, ook al zijn ze afwijkend en onderdeel van de ziekte. Dit verklaart ook waarom CML-patiënten vergeleken met patiënten met acute leukemie betrekkelijk weinig klachten kunnen hebben. Soms is er moeheid of pijn in de botten door de sterke beenmerggroei van binnen, en de vergrote milt kan klachten veroorzaken (dia 4). Bij een groot deel van de CML-patiënten wordt de diagnose echter bij toeval gevonden, bijvoorbeeld tijdens een routine bloedonderzoek verricht voor een keuring.
Een bijzondere afwijking bij CML: het Philadelphia-chromosoom
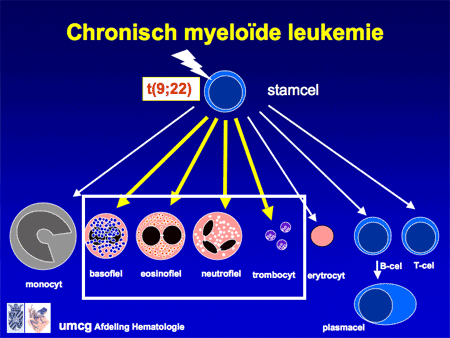
Bij alle vormen van CML is in de vroegste stamcel in het beenmerg een fout ontstaan. Twee chromosomen (de nummers 9 en 22) zijn bij de celdeling gebroken en verkeerd aan elkaar geplakt (translocatie), waardoor nieuwe stukjes naast elkaar zijn komen te liggen (dia 8 en dia 9). Het resultaat is een te kort chromosoom 22 en een te lang chromosoom 9 (dia 11). Dit nieuwe chromosoomproduct (BCR-ABL-gen) maakt een bepaald eiwit dat de witte-bloedcelvoorlopers sterk stimuleert, waardoor deze vaker delen en minder gauw dood gaan. Het resultaat is daardoor een sterke toename van witte cellen, die nog wel normaal uitgerijpt zijn.
De afwijking aan het chromosoom werd in 1960 vastgesteld door Dr. Peter Nowell en Dr. David Hungerford, twee wetenschappers van de Universiteit van Pennsylvania in Philadelphia in de Verenigde Staten van Amerika (dia 10). Voor deze ontdekking kregen zij de Nobelprijs. Zij gaven dit foute chromosoom 22 de naam ‘Philadelphia-chromosoom’, naar de stad waar het was ontdekt. Soms wordt dit chromosoom verkort aangeduid als ‘Ph-chromosoom’.
Voor alle duidelijkheid: deze chromosoomafwijking is tijdens het leven ontstaan, is alleen maar aanwezig in de leukemiecellen en is per definitie dus niet erfelijk en kan ook niet aan het nageslacht doorgegeven worden.
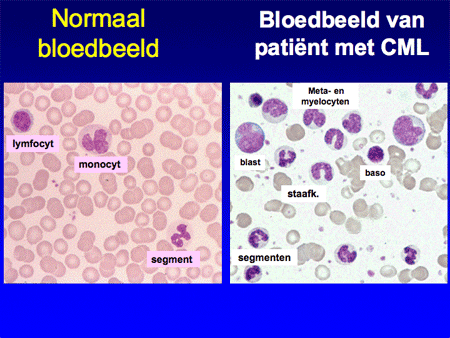
Dia 6
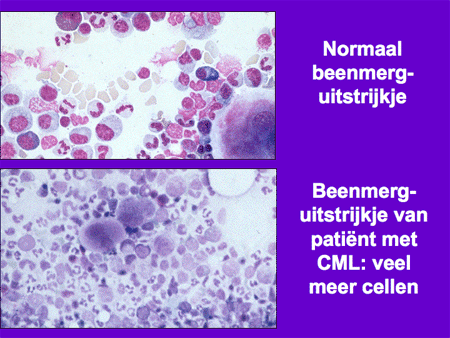
Dia 7
Dia 8
Dia 9

Dia 10

Dia 11
Hoe wordt CML aangetoond?
De diagnose CML wordt aangetoond door middel van bloed- en beenmergonderzoek. Bij het bloedonderzoek vallen de verhoogde witte bloedcellen op. Wanneer deze onder de microscoop worden beoordeeld, is er bijna altijd een karakteristiek patroon te herkennen met allerlei verschillende typen witte bloedcellen van verschillende rijpheid. Het beenmergonderzoek laat ook de toename van witte cellen zien. Het beenmerg bevat veel meer cellen dan normaal. De toegenomen celgroei kan de botpijn verklaren. Immers, beenmerg bevindt zich in de mergholten in de botten. Bij groei in het beenmerg zal er van binnen uit druk ontstaan in deze mergholtes.
Voor de definitieve diagnose CML is chromosomenonderzoek nodig om het karakteristieke Philadelphia-chromosoom aan te tonen. Naast chromosomenonderzoek kan de chromosoombreuk met het nieuwe eiwit ook met moderne andere technieken vastgesteld worden, de zogenaamde PCR-methode (dia 12). Deze techniek is erg belangrijk om na behandeling van de CML aan te tonen of er nog restziekte aanwezig is.

Dia 12
Natuurlijk beloop van CML (zonder behandeling)
De ziekte blijkt een aantal fasen te doorlopen (dia 13). De eerste jaren is het beeld rustig; deze fase wordt chronische fase CML genoemd. Na ongeveer drie tot vier jaar wordt het beeld onrustiger doordat er in de CML-stamcellen nieuwe afwijkingen bijkomen. Daardoor gaat de ziekte zich meer gedragen richting acute leukemie. Na een overgangsfase van meestal enkele maanden (acceleratiefase) ontstaat de zogenaamde blastencrise, waarbij het beeld sterk doet denken aan dat van acute leukemie.
De meeste patiënten blijken bij het vaststellen van de ziekte in de chronische fase te verkeren, maar een enkele keer komt het toch voor dat de CML al verder gevorderd is en zich presenteert in de acceleratiefase of zelfs blastencrise. In dat geval krijgen patiënten een behandeling zoals ook bij acute leukemie gegeven wordt, maar de resultaten zijn helaas veel minder goed dan die bij nieuw ontstane acute leukemie.

Dia 13
Therapie van CML
Er is de laatste jaren een spectaculaire verbetering opgetreden in de behandelingsresultaten. Tot ongeveer vijftien jaar geleden was het gebruikelijk CML-patiënten te behandelen met chemotherapie en alfa-interferoninjecties. Deze therapie werkte levensverlengend, maar had veel bijwerkingen. Bij de meerderheid van de patiënten ontstond uiteindelijk toch een blastencrise die tot de dood leidde (dia 14).
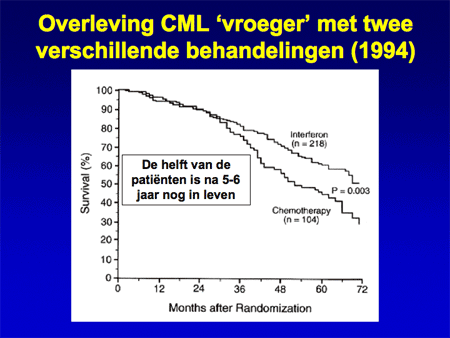
Dia 14
Een alternatieve behandeling bestond dan ook uit stamceltransplantatie, waarbij de CML zo radicaal mogelijk uitgeschakeld werd, gevolgd door teruggave van gezonde bloedvormende stamcellen, bij voorkeur van een broer of zus. Ook deze behandeling ging (en gaat) met veel bijwerkingen gepaard.
Sinds de ontdekking van het resultaat van het Philadelphia-chromosoom, namelijk het ontstaan van een nieuw stukje chromosoom dat een nieuw eiwit vormt, is de therapie radicaal veranderd. Er zijn inmiddels meerdere blokkerende medicijnen ontwikkeld die specifiek dit nieuwe eiwitproduct (een tyrosinekinase) kunnen remmen. Remming hiervan resulteert vervolgens in het afsterven van de CML-cellen en dus in het verdwijnen van de ziekte. Een voorbeeld van zo’n blokkerend medicijn, waar ook de meeste ervaring mee is opgebouwd, is imatinib (Glivec®).
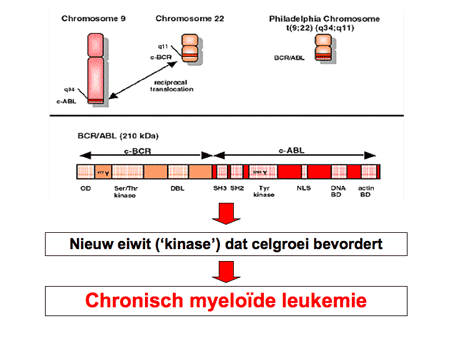
Dia 15. Een nieuw eiwit (kinase) bevordert de celgroei
Alle nieuwe patiënten met CML zullen dan ook – tenzij ze meedoen met een nieuwe behandelstudie – met imatinib behandeld worden. Patiënten worden vervolgens elke drie maanden op de polikliniek gecontroleerd. Het doel van de behandeling is om zo grondig mogelijk alle CML-activiteit uit te schakelen. Aanvankelijk zal er driemaandelijks een beenmergonderzoek nodig zijn (voor chromosomenonderzoek), naderhand kan de ziekteactiviteit via bloedonderzoek vervolgd worden (PCR-methode). Telkens wanneer de resultaten tegenvallen, wordt actie ondernomen: de dosering van de imatinib kan opgehoogd worden of er kan besloten worden het middel te vervangen door andere zogenaamde 2e generatie blokkerende medicijnen, zoals dasatinib, nilotinib of bosutinib.

Dia 16
Bij de grote meerderheid van de CML-patiënten zal vervolgens in de loop der maanden vrijwel alle ziekteactiviteit verdwijnen. Bij een minderheid kan in de loop der jaren (doordat de achtergebleven CML-cellen heel slim gaan veranderen (er ontstaan dan “mutaties” in het kernmateriaal van de CML cellen, waardoor imatinib niet meer goed ‘pakt’) de CML-activiteit weer terugkomen. Ook dan is het de moeite waard om de middelen dasatinib, nilotinib of bosutinib in te zetten, of – in het geval van een heel specifieke mutatie-afwijking, de T315i mutatie), het zeer dure middel ponatinib. Komt de ziekte desondanks onvoldoende onder controle, dan kan toch besloten worden over te gaan tot stamceltransplantatie, gebruikmakend van stamcellen van een familiedonor of onverwante donor.
Is het dan een happy end voor patiënten met CML?
Ja en nee. Vergeleken met zo’n tien tot twintig jaar terug is het ziektebeloop onherkenbaar veranderd en zijn de resultaten wonderbaarlijk verbeterd. Zelden heeft een nieuwe ontdekking zoals de chromosoomafwijkingen zo’n impact gehad op de therapieontwikkeling en verbeterde overleving van patiënten. Toch zijn we er nog niet. Zolang niet alle CML-patiënten een volledige verbetering met verdwijnen van de ziekte vertonen, is er reden tot verder onderzoek. Het zou kunnen zijn dat het beter is om meerdere blokkers te combineren, of te variëren in de doseringen. Bij sommige patiënten worden de blokkers niet goed verdragen of ontstaat er in de loop der jaren toch resistentie, door veranderingen in de CML-cellen. Zware behandelingen zoals stamceltransplantatie moeten daarom toch achter de hand gehouden worden voor CML-patiënten bij wie de behandeling met deze nieuwe blokkers faalt.
De hoop is aan de andere kant ook dat bij een groep patiënten bij wie al jaren geen aantoonbare CML activiteit is aangetoond, het mogelijk moet zijn de medicatie blijvend te stoppen. De verwachting is hierbij dus dat bij hen de ziekte echt genezen is. De eerste indrukken zijn overigens zeer gunstig. Bij ongeveer de helft van de patiënten lukt het de imatinib of één van de andere middelen te stoppen zonder dat er weer CML activiteit aantoonbaar terugkomt. Dit lukt overigens alleen als bij deze patiënten al minstens 2 jaar geen enkele ziekteactiviteit meer aantoonbaar was, gemeten met de meest gevoelige techniek die mogelijk is. Bij de helft bij wie de ziekte vervolgens wél weer terugkomt is het hervatten van de medicatie voldoende om alles weer onder controle te krijgen.
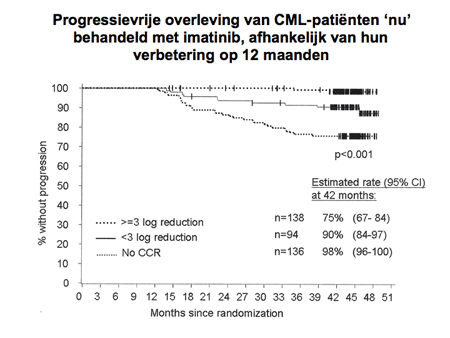
Dia 17
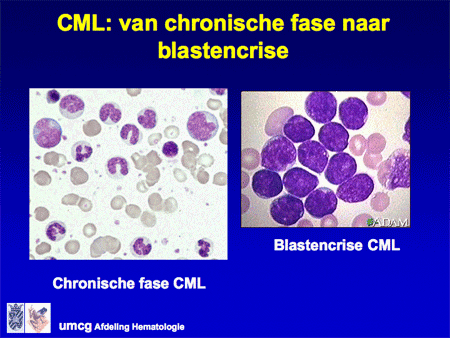
Dia 18

Dia 19
Hulp en ondersteuning
Veel patiënten hebben baat bij contact met de patiëntenvereniging:
Stichting Hematon
Postbus 8152
3503 RD Utrecht
Tel. 030-760 34 60
E-mail: secretariaat@hematon.nl
Website: www.hematon.nl
Deze vereniging zet zich in voor alle patiënten met leukemie, zowel acute leukemie als ook de verschillende vormen van chronische leukemie.




