Introductie
Het diffuus grootcellig B-cellymfoom (DLBCL) behoort tot de agressieve lymfomen. Het is het meest voorkomend subtype non-Hodgkin lymfoom en wordt ongeveer 1300 keer per jaar in Nederland gediagnosticeerd. Klinisch staan lymfadenopathie en bij de uitgebreidere stadia malaise en gewichtsverlies op de voorgrond. De mediane leeftijd van presentatie is rond de 65 jaar. De 5-jaarsoverleving met behandeling is 64% (1) en zonder behandeling 1-3 maanden (2).
Diagnostiek
Anamnese
- Inventarisatie duur en aard van klachten inclusief B-symptomen
- Beoordeling pre-existente performance inclusief beperkende klachten ten gevolge van orgaandysfunctie en met inschatting van ziektegerelateerd conditieverlies
- Mentale fitheid
- Psychosociale omstandigheden
Lichamelijk onderzoek; WHO/ECOG/Frailty
Algemeen lichamelijk onderzoek met speciale aandacht voor:
- WHO performance status
- Hart en longen
- Lymfeklieren
- Hepatosplenomegalie
Laboratoriumonderzoek
- Volledig bloedbeeld inclusief leukocytendifferentiatie, creatinine, leverenzymen, glucose, albumine LDH
- Serologie: hepatitis B, C en HIV
- Indien van toepassing: zwangerschapstest
- Op indicatie: NTproBNP, troponines
Aanvullend onderzoek
Beeldvorming: Bij diagnose: FDG-PET/CT-scan met een CT-scan met contrast van hals, thorax, abdomen (3, 4, 5).
Pathologie: bij voorkeur een volledige klier of een ruim excisie- of incisiebiopt van een betrokken nodale of extranodale tumorlokalisatie (6). Bij uitzondering kan een dikke naaldbiopt (14 G) volstaan. Cytologisch onderzoek is onvoldoende voor het stellen van de diagnose.
FISH-onderzoek: voor de differentiatie met dubbel-hit lymfoom (MYC-FISH + BCL2- en/of BCL6-translocatie). Indien het een dubbel-hit lymfoom betreft bepaling translocatie partner MYC (IgH versus non-IgH).
ECG
Liquordiagnostiek: op indicatie (bij hoge CNS-IPI)
TTE: op indicatie (anthracyclines)
Beenmerg:
De gouden standaard was tot recent nog het beenmergbiopt. Recente studies, publicaties en guidelines suggereren echter dat in alle of in ieder geval de meeste gevallen, het beenmergbiopt achterwege gelaten kan worden indien er een FDG-PET/CT gemaakt is (7–9).
- Indien de FDG-PET/CT aanwijzingen laat zien voor beenmergbetrokkenheid, kan beenmergbiopsie achterwege worden gelaten.
- Indien de FDG-PET/CT geen aanwijzingen laat zien voor beenmergbetrokkenheid (negatieve PET), wordt aangeraden een beenmergbiopsie te doen indien dit consequenties heeft voor de prognose en/of het te voeren beleid (zelden het geval).
Risicoclassificatie en prognose
Risicoclassificatie
De prognose is in te schatten op basis van de IPI (international Prognostic Index) score en aaIPI (age-adjusted International Prognostic index) score (tabel 2), daarin is ook de stadiëring opgenomen. Voor de stadiëring van DLBCL wordt de Lugano classificatie gebruikt (tabel 1). Ter bepaling van het risico op een CNS recidief wordt de CNS-IPI berekend. Twaalf procent van de patiënten heeft een hoog CNS-IPI risico, bij hen moet CNS profylaxe worden overwogen. (10)
| Stadium | Betrokkenheid | Extranodale (E) status |
| Limited | ||
| I | 1 lymfekliergroep | 1 extranodale laesie zonder lymfeklierbetrokkenheid |
| II | > 2 lymfekliergroepen aan dezelfde kant van het diafragma | Stadium I of II door lymfeklier uitbreiding met beperkte dichtbijgelegen extranodale betrokkenheid |
| Advanced | ||
| III | Lymfeklieren aan beide kanten van het diafragma; Lymfeklieren boven het diafragma met miltbetrokkenheid |
Niet van toepassing |
| IV | Bijkomende niet aansluitende extranodale betrokkenheid | Niet van toepassing |
| Prognostisch ongunstige factoren IPI: | Leeftijd > 60 jaar LDH > 1× normaal Performance status > 2 Stadium III of IV > 1 extranodale lokalisatie Nier- en/of bijnierbetrokkenheid (alleen CNS-IPI) |
| IPI: | |
| Laag risico | 0 of 1 risicofactor |
| Laag intermediair risico | 2 risicofactoren |
| Hoog intermediair risico | 3 risicofactoren |
| Hoog risico | 4 of 5 risicofactoren |
| ‘Age adjusted’ IPI (aaIPI) NB Geen punten voor extranodale lokalisaties; leeftijd vervalt | |
| Laag risico | Geen risicofactor |
| Laat intermediair risico | 1 risicofactor |
| Hoog intermediair risico | 2 risicofactoren |
| Hoog risico | 3 risicofactoren |
| CNS IPI | |
| Laag | 0-1 risicofactor |
| Intermediair risico | 2-3 risicofactoren |
| Hoog risico | 4-6 risicofactoren |
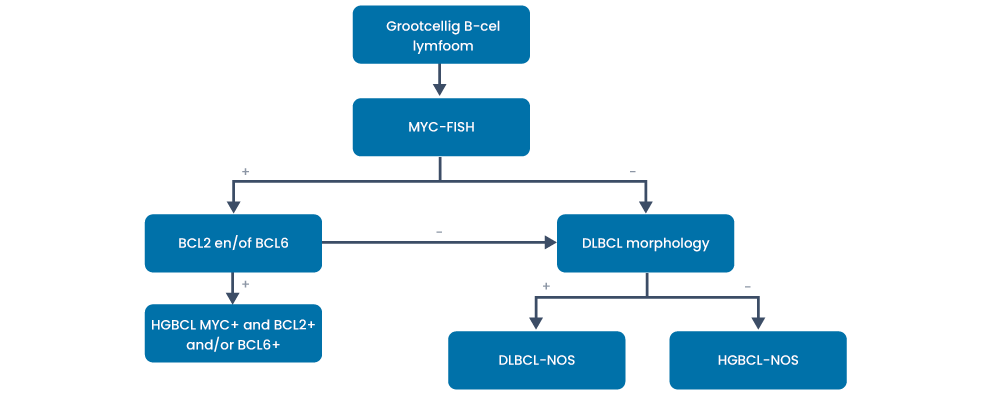
Double- en triple-hit hooggradig B-cellymfoom
Patiënten met een MYC- en BCL2- en/of BCL6-translocatie hebben een slechtere prognose dan patiënten met alleen of geen MYC-translocatie.
Hoewel de fusie partner van MYC (ig-MYC versus non ig-MYC) een belangrijke prognostische waarde lijkt te hebben, is dit formeel nog niet opgenomen in de richtlijn. Onderzoek laat zien dat de prognose van non IgH-MYC vergelijkbaar lijkt met DLBCL en prognostisch minder overeen komt met dubbel-hit lymfoom (11).
Prognose
De 5-jaarsoverleving met behandeling is 64% (1) en zonder behandeling 1-3 maanden (2). Indien de PET-scan metabool complete remissie na afloop van R-CHOP behandeling toont dan is de 2-jaars progressievrije overleving 76-97% (12).
Behandeling
Filter trials en protocollen voor dit ziektebeeldEerste lijn
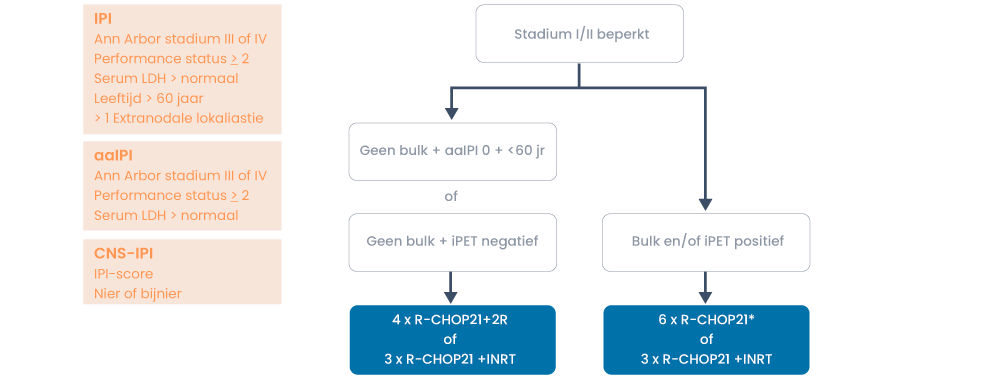
(13)
*Drie keer R-CHOP21 +INRT is de tweede keuze en wordt alleen gegeven indien 6× R-CHOP21 niet haalbaar is vanwege toxiciteit.
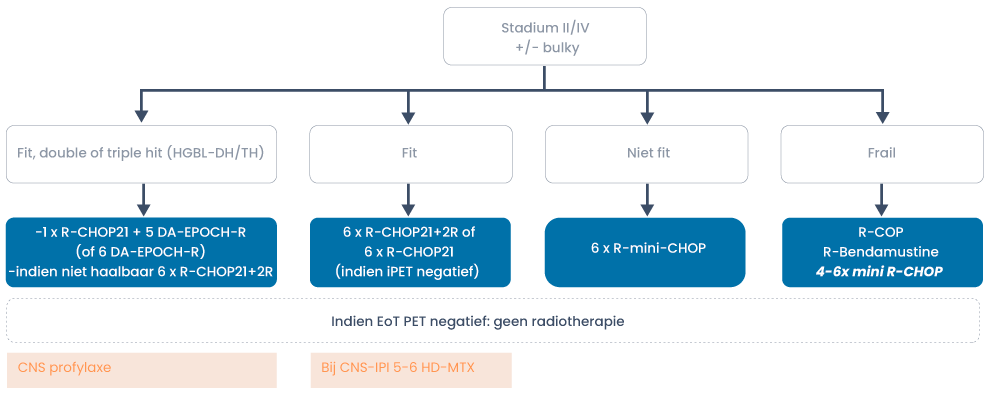
Er zijn verschillende studies geweest die hebben onderzocht of toevoeging van nieuwe middelen (ibrutinib, lenalidomide en bortezomib) aan R-CHOP van toegevoegde waarde zijn. Geen van deze drie middelen heeft een verbetering van progressievrije overleving en overall survival laten zien. Meer recent is de fase 3-studie gepubliceerd met R-CHP polatuzumab vedotin versus R-CHOP. De studie toonde een verschil in 2-jaar PFS van 6,5%, maar geen verschil in de 2-jaar OS. Er is momenteel geen vergoedingsstatus voor R-CHP polatuzumab.
Double- en triple-hit hooggradig B-cellymfoom
Intensievere chemotherapieschema’s geven een hoger complete remissie (CR) percentage en langere progressievrije overleving (PFS) (21–23). Daarnaast hebben ze een hogere kans op CNS recidief wat maakt dat bij hen CNS profylaxe wordt geadviseerd (21). Buiten studieverband wordt DA-EPOCH met CNS profylaxe geadviseerd. Hoewel dit schema geen betere overleving geeft, leidt het wel tot een hoger CR percentage en PFS. Dit schema is ook prospectief geëvalueerd en resulteerde in een 4-jaars EFS van 71% en OS van 77% (24).
Indien DA-EPOCH-R te toxisch wordt geacht, kan 6 × R-CHOP21 met CNS profylaxe gegeven worden. Er is geen evidence om in complete remissie te consolideren met een autologe stamceltransplantatie (26).
Ouderen
Bij ouderen is het belangrijk goed af te wegen of zij de toxiciteit van de behandeling kunnen verdragen. Dit hangt af van leeftijd, performance en comorbiditeit. Er wordt onderscheid gemaakt tussen fitte, niet-fitte en kwetsbare patiënten. Kwetsbare patiënten kenmerken zich door hogere leeftijd (≥ 80 jaar) in combinatie met sterk verminderd functioneren en/of comorbiditeit, voor hen wordt daarom de grootste beleidsaanpassing geadviseerd. De niet-fitte patiënt is of ≥ 80 jaar maar met een goede performance en beperkte comorbiditeit of jonger dan 80 jaar met comorbiditeit Bij kwetsbare patiënten is de voorkeur om te starten met R-mini-CHOP met eventueel escalatie naar R-CHOP.
Voor start van R-(mini-)CHOP wordt bij niet-fitte en/of oudere patiënten een prefase met steroïden geadviseerd (5 dagen prednisolon, 60 – 100 mg/dag) (27).
Ondersteuning met G-CSF wordt in ieder geval geadviseerd bij de 1e cyclus (PEG-filgastrim 6 mg s.c. op dag 2 van de cyclus).
Response-evaluatie
Interim respons
Het advies is om responsevaluatie middels PET-scan te verrichten niet middels CT-scan na 2 kuren. De negatief voorspellende waarde van een interim-PET is hoog (> 80%) (28, 29). Bij een negatieve interim-PET-/CT-scan kan dit leiden tot de-escalatie van therapie (omissie van 2 × rituximab). Bij een positieve PET-scan, maar met een partiële metabole respons (resterende ziekte maar afname van FDG-aviditeit) wordt geadviseerd om de behandeling met R-CHOP te continueren. Escalatie wordt in dat geval niet door literatuur ondersteund (30, 31).
In het geval van stabiele of progressieve ziekte wordt in het algemeen geadviseerd om over te gaan naar tweedelijnsbehandeling.
Einde behandeling respons
De responsevaluatie na de laatste kuur dient bij voorkeur na minimaal 4 tot 6 weken te zijn. Na radiotherapie moet de responsevaluatie bij voorkeur pas na tenminste 3 maanden zijn. Indien eerder beeldvorming wordt verricht bestaat het risico op fout-positieve uitslagen t.g.v. radiatie-inflammatie.
Bij een positieve PET-scan bij EoT kunnen de volgende opties worden overwogen:
- Bij geïsoleerde FDG-stapeling in een oorspronkelijke laesie met verwachte milde toxiciteit overweeg radiotherapie (32).
- Bij multipele FDG-avide laesies op oorspronkelijke DLBCL lokalisatie biopteren. Indien niet mogelijk PET-scan herhalen na 2-3 maanden.
- Bij nieuwe FDG-avide laesie buiten oorspronkelijke DLBCL lokalisatie: aanvullende diagnostiek d.m.v. nieuw biopt geadviseerd.
Tweede lijn
Ongeveer 80% van de patiënten wordt in de eerste lijn genezen met immunochemotherapie (R-CHOP). In het geval van verdenking recidief dient dit histologisch bewezen te worden, aangezien er ook sprake kan zijn van een andere ziekte of er verandering kan zijn opgetreden in het type lymfoom.
Patiënten met een recidief of refractaire ziekte hebben onbehandeld een prognose van enkele maanden. Patiënten met primair refractaire ziekte hebben een mediane overleving van slechts zes maanden indien wel tweedelijns chemotherapie wordt gestart. Bij behandeling voor een recidief DLBCL is de prognose beter.
Intensieve behandeling
Bij fitte patiënten die (nog) niet in aanmerking komen voor CAR-T behandeling is het advies om te behandelen met R-DHAP of R-GDP gevolgd door BEAM en autologe stamceltransplantatie, deze behandeling is in opzet curatief.
Patiënten komen in principe in aanmerking voor hoge dosis chemotherapie en autologe stamceltransplantatie tot de leeftijd van 70 jaar. Vanaf 70 jaar of bij minder fitte patiënten is het een individuele beslissing, op basis van comorbiditeit (33). De non-relapse mortality blijkt rond de 7% te zijn in een retrospectieve studie.
Er is geen indicatie voor onderhoudsbehandeling na autologe stamceltransplantatie.
Patiënten niet geschikt voor autoloog
De behandeling is in principe palliatief en gericht op behoud van kwaliteit van leven. Er is geen standaardtherapie. De keuze zal afhankelijk zijn van restverschijnselen van eerdere behandelingen, comorbiditeit, toxiciteit en effectiviteit. Mogelijk kan patiënt in studieverband worden behandeld. Dit geniet de voorkeur en daarom is het zinvol om deze mogelijkheid te inventariseren bij een van de academische ziekenhuizen.
CAR T-celtherapie
Behandeling van recidief/refractair DLBCL vindt bij voorkeur plaats in studieverband. Bij voorkeur is er (bij twijfel) vroegtijdig overleg met een academisch centrum.
Buiten studieverband is behandeling met CD-19 gerichte CAR T-cellen aangewezen voor patiënten met DLBCL (inclusief getransformeerd folliculair lymfoom en PMBCL) die:
- primair refractair zijn op eerstelijnsbehandeling met R-CHOP
- een recidief hebben binnen 12 maanden na voltooien van de eerstelijnsbehandeling
- tenminste twee eerdere lijnen systemische behandeling hebben gehad
Er is geen leeftijdsgrens voor behandeling met CD19 CAR T-cellen, mits patiënt voldoet aan geschiktheidscriteria.
Bijzonderheden/specifieke aandachtspunten, ziekte-/behandelinggerelateerd
Indicaties voor CNS-profylaxe
Over het algemeen hebben patiënten een laag risico op CZS lokalisatie, welke verder wordt gereduceerd door de behandeling met rituximab tot 2-4% (34–36). De prognose is slecht met een 1-jaarsoverleving van 22-58% (37, 38). Onder andere patiënten met een lokalisatie in de testis, nier en bijnier, uterus en mamma hebben een verhoogd risico. Om het risico in te schatten wordt de CNS-IPI gebruikt (zie tabel 2). Advies vanuit de richtlijn is om bij een CNS-IPI < 3 geen LP te verrichten omdat de kans op een CZS recidief < 5% is. Bij een CNS-IPI 4-6 is de kans op CZS recidief >5% en wordt LP diagnostiek aanbevolen om asymptomatische CZS lokalisatie vroegtijdig te kunnen behandelen. Gezien het ontbreken van prospectieve studies en het gebrek aan ondersteuning van effectiviteit door retrospectieve data wordt niet standaard geadviseerd CZS profylaxe te geven. Bij een zeer hoog risico (>30%, CNS-IPI 6) en in specifieke situaties (zie hieronder) valt dit wel te overwegen, waarbij klinische factoren en wensen van de patiënt moeten worden meegenomen.
Specifieke situaties:
- Lokalisatie in testis (risico op CZS recidief >30%); advies 4x intrathecale MTX profylaxe, bij CR aansluitend nog 2x HD-MTX IV
- Intravasculair B-cellymfoom; advies 4x intrathecale MTX profylaxe, bij CR aansluitend nog 2x HD-MTX IV
- DLBCL bij HIV positieve patiënten advies laagdrempelig diagnostische LP te verrichten
- High grade B-cel lymfoom met MYC en BCL2 rearrangement, en met MYC en BCL6 rearrangement; het advies is om conform de H152 studie te behandelen met DA-EPOCH-R en 6x MTX IT op dag 1, HD-MTX is niet te combineren met DA-EPOCH-R. Als alternatief kan ook R-CHOP, lenalidomide met5x MTX IT worden gegeven, of R-CHOP met 3x HD-MTX.
Follow-up
Na de behandeling is het advies om in het eerste jaar elke 3 maanden en in het tweede jaar elke 6 maanden de patiënt te controleren op recidief. Er is geen evidence dat routinematige beeldvorming de uitkomsten verbetert. Aangezien na 2 jaar de kans op een recidief sterk is afgenomen, kan de follow-up dan worden beëindigd, tenzij de patiënt op grote gebieden is bestraald. In het bijzonder gaat dit op als er vitale organen zoals hart of longen in het bestralingsveld lagen. De follow-up, gericht op langetermijneffecten, kan dan na 5 jaar hervat worden.
Literatuurlijst
- Dinmohamed AG et al. Hemato-oncologische zorg in Nederland: een overzicht op basis van 5 jaar data uit de Nederlandse Kankerregistratie. IKNL. (2021)
- Dinmohamed AG. Personal communication. (2021)
- Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol 2014; 32: 3059–3068.
- Barrington SF, Mikhaeel NG, Kostakoglu L, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014; 32: 3048–3058
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) B-Cell Lymphomas Version 2.2019-March 6, 2019.
- Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues (revised 4th edition). IARC Lyon 2017.
- Berthet L, Cochet A, Kanoun S, et al. In newly diagnosed diffuse large B-cell lymphoma, determination of bone marrow involvement with 18F-FDG PET/CT provides better diagnostic performance and prognostic stratification than does biopsy. J Nucl Med 2013;54(8):1244-50.
- Adams HJ, Kwee TC, de Keizer B, et al. FDG PET/CT for the detection of bone marrow involvement in diffuse large B-cell lymphoma: systematic review and meta-analysis. Eur J Nucl Med Mol Imaging. 2014;41(3):565-74.
- El Karak F, Bou-Orm IR, Ghosn M, et al. PET/CT Scanner and Bone Marrow Biopsy in Detection of Bone Marrow Involvement in Diffuse Large B-Cell Lymphoma. PLoS One 2017;12(1):e0170299.
- Schmitz N et al; CNS International Prognostic Index: A Risk Model for CNS Relapse in Patients With Diffuse Large B-Cell Lymphoma Treated With R-CHOP. J Clin Oncol 2016 Sep 10;34(26):3150-6
- Rosenwald A et al; Prognostic Significance of MYC Rearrangement and Translocation Partner in Diffuse Large B-Cell Lymphoma: A Study by the Lunenburg Lymphoma Biomarker Consortium J Clin Oncol. 2019 Dec 10;37(35):3359-3368.
- Barrington S, Trotman J. The role of PET in the first-line treatment of the most common subtypes on non-Hodgkin lymphoma. Lancet Haematol2021; 8:e80-93
- Poeschel V, Held G, Ziepert M, et al. Four versus six cycles of CHOP chemotherapy in combination with six applications of rituximab in patients with aggressive B-cell lymphoma with favourable prognosis (FLYER): a randomised, phase 3, non-inferiority trial. Lancet 2020;394(10216):2271-81.
- Davies A, Cummin TE, Barrans S, et al. Gene-expression profiling of bortezomib added to standard chemoimmunotherapy for diffuse large B-cell lymphoma (REMoDL-B): an openlabel, randomised, phase 3 trial. Lancet Oncol 2019;20(5):649-62.
- Younes A. A Global, Randomized, Placebo-Controlled, Phase 3 Study of Ibrutinib Plus Rituximab, Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone (RCHOP) in Patients with Previously Untreated Non-Germinal Center B-Cell-like (GCB) Diffuse Large B-Cell Lymphoma (DLBCL) ASH 2018 abstract 784; 2018.
- Nowakowski GS, Chiappella A, Witzig TE, et al. ROBUST: Lenalidomide-R-CHOP versus placebo-R-CHOP in previously untreated ABC-type diffuse large B-cell lymphoma. Future Oncol 2016;12(13):1553-63.
- Sehn L, Culligan DJ, Gironella M, et al. No Added Benefit of Eight Versus Six Cycles of CHOP When Combined with Rituximab in Previously Untreated Diffuse Large B-Cell Lymphoma Patients: Results from the International Phase III GOYA Study. Blood 2018;ASH 2018(132):783.
- Wasterlid T, Biccler JL, Brown PN, et al. Six cycles of R-CHOP-21 are not inferior to eight cycles for treatment of diffuse large B-cell lymphoma – A Nordic Lymphoma Group population-based study. Ann Oncol 2018.
- Issa DE et al A population-based study on different regimens of R-CHOP in patients with newly diagnosed DLBCL in The Netherlands Leuk Lymphoma 2021 Mar;62(3):549-559et 27
- Duhrsen U, Muller S, Hertenstein B, et al. Positron Emission Tomography-Guided Therapy of Aggressive Non-Hodgkin Lymphomas (PETAL): A Multicenter, Randomized Phase III Trial. J Clin Oncol. 2018.
- Oki Y, Noorani M, Lin P, et al. Double hit lymphoma: the MD Anderson Cancer Center clinical experience. Br J Haematol 2014;166(6):891-901.
- Petrich AM, Gandhi M, Jovanovic B, et al. Impact of induction regimen and stem cell transplantation on outcomes in double-hit lymphoma: a multicenter retrospective analysis. Blood 2014;124(15):2354-61.
- Howlett C, Snedecor SJ, Landsburg DJ, et al. Front-line, dose-escalated immunochemotherapy is associated with a significant progression-free survival advantage in patients with double-hit lymphomas: a systematic review and meta-analysis. Br J Haematol 2015;170(4):504-14.
- Dunleavy K, Fanale MA, Abramson JS, et al. Dose-adjusted EPOCH-R (etoposide, prednisone, vincristine, cyclophosphamide, doxorubicin, and rituximab) in untreated aggressive diffuse large B-cell lymphoma with MYC rearrangement: a prospective, multicentre, single-arm phase 2 study. Lancet Haematol 2018;5(12):e609-e17.
- Chamuleau MED, Burggraaff CN, Nijland M, et al. Treatment of patients with MYC rearrangement positive large B-cell lymphoma with R-CHOP plus lenalidomide: results of a multicenter HOVON phase II trial. Haematologica 2019.
- Campbell BA, Connors JM, Gascoyne RD, et al. Limited-stage diffuse large B-cell lymphoma treated with abbreviated systemic therapy and consolidation radiotherapy: involved-field versus involved-node radiotherapy. Cancer 2012;118(17):4156-65.
- Pfreundschuh M et al. Six versus eight cycles of bi-weekly CHOP-14 with or without rituximab in elderly patients with aggressive CD20+ B-cell lymphomas: a randomised controlled trial (RICOVER-60). Lancet Oncol 2008;9(2):105-16
- Eertink JJ et al, Optimal timing and criteria of interim PET in DLBCL: a comparative study of 1692 patients, Blood Adv 2021;5(9):2375-2384.
- Burggraaff CN et al Predictive value of interim positron emission tomography in diffuse large B-cell lymphoma: a systematic review and meta-analysis. Eur J Nucl Med Mol Imaging 2019 Jan;46(1):65-79.
- Persky DO, Positron Emission Tomography-Directed Therapy for Patients With Limited-Stage Diffuse Large B-Cell Lymphoma: Results of Intergroup National Clinical Trials Network Study S1001 J Clin Oncol 2020;38(26):3003-3011.
- Dührsen U et al; Positron Emission Tomography-Guided Therapy of Aggressive NonHodgkin Lymphomas (PETAL): A Multicenter, Randomized Phase III Trial. J Clin Oncol. 2018 Jul 10;36(20):2024-2034
- Freeman CL et al; Long-term results of PET-guided radiation in patients with advanced-stage diffuse large B-cell lymphoma treated with R-CHOP. Blood 2021 Feb 18;137(7):929-938
- Sun L, Li S, El-Jawahri A, et al. Autologous Stem Cell Transplantation in Elderly Lymphoma Patients in Their 70s: Outcomes and Analysis. Oncologist 2018;23(5):624- 630
- Gleeson, M., Counsell, N., Cunningham, D., Chadwick, N., Lawrie, A., Hawkes, E. A., McMillan, A., Ardeshna, K. M., Jack, A., Smith, P., Mouncey, P., Pocock, C., Radford, J. A., Davies, J., Turner, D., Kruger, A., Johnson, P., Gambell, J., and Linch, D. (2017) Central nervous system relapse of diffuse large B-cell lymphoma in the rituximab era: results of the UK NCRI R-CHOP-14 versus 21 trial, Ann Oncol 28, 2511-2516.
- Boehme, V., Zeynalova, S., Kloess, M., Loeffler, M., Kaiser, U., Pfreundschuh, M., and Schmitz, N. (2007) Incidence and risk factors of central nervous system recurrence in aggressive lymphoma–a survey of 1693 patients treated in protocols of the German High-Grade NonHodgkin’s Lymphoma Study Group (DSHNHL), Ann. Oncol 18, 149-157.
- Boehme, V., Schmitz, N., Zeynalova, S., Loeffler, M., and Pfreundschuh, M. (2009) CNS events in elderly patients with aggressive lymphoma treated with modern chemotherapy (CHOP-14) with or without rituximab: an analysis of patients treated in the RICOVER-60 trial of the German High-Grade Non-Hodgkin Lymphoma Study Group (DSHNHL), Blood 113, 3896-3902.
- Doorduijn, J. K., van Imhoff, G. W., van der Holt, B., Schouten, H. C., Schaafsma, M. R., MacKenzie, M. A., Baars, J. W., Kersten, M. J., Lugtenburg, P. J., van den Bent, M. J., Enting, R. H., Spoelstra, F. M., Poortmans, P., and Bromberg, J. E. (2016) Treatment of secondary central nervous system lymphoma with intrathecal rituximab, high-dose methotrexate, and R-DHAP followed by autologous stem cell transplantation: results of the HOVON 80 phase 2 study, Hematol Oncol.
- Korfel, A., Elter, T., Thiel, E., Hanel, M., Mohle, R., Schroers, R., Reiser, M., Dreyling, M., Eucker, J., Scholz, C., Metzner, B., Roth, A., Birkmann, J., Schlegel, U., Martus, P., Illerhaus, G., and Fischer, L. (2013) Phase II study of central nervous system (CNS)-directed chemotherapy 55 including high-dose chemotherapy with autologous stem cell transplantation for CNS relapse of aggressive lymphomas, Haematologica 98, 364-370.




