Klassieke HCL
De klassieke haarcelleukemie of hairy-cell leukemia (HCLc) is een rijpcellige chronische B-celmaligniteit, gekarakteriseerd door pancytopenie vanwege beenmerginfiltratie met fibrose, splenomegalie en symptomen van vermoeidheid en infecties. Het is een zeldzame aandoening die in Nederland gemiddeld 60 keer per jaar wordt vastgesteld, 4 keer zo vaak bij mannen als bij vrouwen. De mediane leeftijd bij presentatie is 59 jaar (5). Bij HCLc is er altijd de BRAFV600E-mutatie, waardoor activatie optreedt van BRAF, MEK en ERK, de zogenoemde ‘MAPK pathway’ (18).
Variant HCL (HCLv) heeft geen BRAFV600E-mutatie en wordt beschouwd als een aparte entiteit.
Onderzoek
- koorts, infecties, malaise, gewichtsverlies;
- miltgrootte, hepatomegalie, lymfadenopathie;
- bloedbeeld, m.n. leukocytopenie met granulocytopenie en monocytopenie; vaak – maar niet altijd – circulerende hairy cellen;
- lever- en nierfunctie, urinezuur;
- CRP;
- immunofenotypering: B-cel met als specifieke marker CD103; typisch fenotype is een B-cel met sterke expressie van CD19 en IgS, die positief is voor CD20, CD11c, CD25, CD103, FMC7, CD200 en negatief voor CD24 in de HCLc;
- HCLv te onderscheiden door leuko- en lymfocytose, afwezigheid van monocytopenie, negativiteit voor CD25 en positiviteit voor CD24;
- hepatitis B, C, HIV-status voor starten van behandeling.
Bij onduidelijkheid/twijfel over de diagnose:
- eventueel (bij twijfel aan de diagnose): BRAF genmutatie-analyse V600E (kan op de meeste PA-laboratoria gedaan worden);
- beenmergaspiraat en -biopsie bij geen eenduidige diagnose;
- X-thorax ter uitsluiting actieve (opportunistische) infecties;
- echo abdomen alleen op indicatie.
Toelichting
- HCL-patiënten zijn te beschouwen als ernstig immuungecompromitteerde patiënten. Zij hebben een verhoogd infectierisico, vooral als ze neutropeen en monocytopeen zijn. Naast ‘gewone’ bacteriën en schimmels zijn zij m.n. vatbaar voor mycobacteriële infecties en Yersinia. Tijdens behandeling met purine-analoga komt daar door T-cellymfocytopenie nog een verhoogd risico bij voor Pneumocystis jiroveci en herpesvirussen.
Er is een verhoogde incidentie van auto-immuunziekten en vasculitis, evt. gepaard gaande met systemische klachten. Ook tweede maligniteiten komen – net als bij CLL – vaker voor bij patiënten met HCL.
Differentiaal diagnose
- Andere indolent verlopende lymfatische maligniteiten als CLL en indolent NHL.
- HCLv met grotere, ronde kernen en grote nucleolus, te differentiëren van B-cel prolymfocytenleukemie (B-PLL); HCLv reageert veel minder goed op (chemo)therapie en gedraagt zich meer als een prolymfocytenleukemie.
- Marginalezonelymfoom in de milt, vroeger genoemd ‘splenic lymphoma with villous lymphocytes’ (SLVL).
Criteria symptomatische HCLc
- Anamnese: koorts, recidiverende of ernstige infecties, klachten van splenomegalie, extreme vermoeidheid, gewichtsverlies > 10% in 6 maanden
- Lichamelijk onderzoek: progressieve splenomegalie
- Bloedonderzoek: Hb < 6,8 mmol/l of trombocyten < 100 × 109/l of neutrofiele granulocyten < 10 × 109/l
Behandeling
Filter trials en protocollen voor dit ziektebeeldAlgemeen
- Bij asymptomatisch HCLc wait and see-beleid
- Bij symptomatische HCLc eerste keus behandeling met cladribine (zie hieronder)
- Bij ernstige infectie bij diagnose eerst starten met (Peg)interferon (zie hieronder)
- Antibiotische profylaxe, m.n. met cotrimoxazol en fluconazol, is wenselijk tijdens neutropenie, al is er een verhoogd risico van allergie (m.n. tegen cotrimoxazol maar ook tegen o.a. allopurinol) bij gebruik van purine-analoga
- Ook als er geen neutropenie (meer) is: cotrimoxazol 480 mg 1 × per dag als profylaxe tegen PJP, tot 1 jaar na staken purine-analoog of herstel T-cellymfocytopenie
- Te overwegen: valaciclovir 2 × 500 mg dd als profylaxe tegen herpes zoster en herpes simplex tot 6 maanden na behandeling
- Purine-analoga kunnen aanleiding geven tot nefrotoxiciteit, in grote mate terug te voeren op een cellysis syndroom. Dit kan worden voorkomen met extra hydratie voor start van de behandeling. Let op, allopurinol kan allergische reactie veroorzaken
- Bij behandeling met purine-analoga worden bloedproducten bestraald tot 1 jaar na behandeling
Specifiek
- Purine-analoga
- Deoxyadenosine (2-CDA, Cladribine, Leustatin® of Litak®). Cladribine kan intraveneus (Leustatin) of subcutaan (Litak) toegediend worden. De bio-beschikbaarheid is volledig identiek.
Er lijkt geen verschil in uitkomst te zijn tussen 5-daagse kuur 0.12-0.14 mg/kg/d als 2-uurs infusie of subcutane injectie met dezelfde dosis. De toediening van de Cladribine (i.v. of s.c.) kan dagelijks gegeven worden tijdens 1 week (5 giften) of 1 keer/week, 6 weken achtereen.
In het UMCG wordt vaak de voorkeur gegeven aan een weekschema van 0.12-0.14 mg/kg/wk in 2 uur i.v. of s.c. (11, 14, 21), gezien zijn grotere flexibiliteit en patiëntvriendelijkheid. Ondanks het spatiëren, is het infectierisico (afgemeten als graad 3/4 infecties) niet lager dan met het 5-daagse schema.
- Deoxyadenosine (2-CDA, Cladribine, Leustatin® of Litak®). Cladribine kan intraveneus (Leustatin) of subcutaan (Litak) toegediend worden. De bio-beschikbaarheid is volledig identiek.
Deoxycoformycine (DCF, Pentostatin, Nipent®) 4 mg/m2/1-3 weken i.v. × 6 -12 (kan snel inlopen) is equivalent aan Cladribine wat betreft remissiepercentage en remissieduur (3). Is niet kruisreactief (6).
Actieve infectie is een contra-indicatie voor het starten van purine-analoog! Interferon-alfa kan dan gegeven worden tot de infectie onder controle is, alsnog gevolgd door een purine-analoog.
- Interferon-α (IFN)
3 ME 3 × per week gedurende 1 jaar (Grever 2014), daarna evt. maintenance 1× per week of PegIntron 0.5-1 μg/kg/week. Ook veel lagere doses interferon-alfa zijn effectief gebleken (tot zelfs 0.2 ME per week). Dus doseren op geleide van tolerantie.
Indicaties:- actieve infectie, waardoor contra-indicatie voor purine-analoga;
- intolerantie c.q. resistentie voor purine-analoga;
- recidief c.q. progressie HCL na eerdere respons op purine-analoga: IFN tot optimaal hematologisch effect (3-6 mnd), gevolgd door purine-analoga (als boven).
I.t.t. purine-analoga slechts 5% kans op curatie. Responsen treden langzaam op, pas na enige maanden therapie.
- Rescue-therapie
- Anti-CD20 (rituximab) 375 mg/m2/wk (9), liefst voorafgegaan door behandeling met cladribine (20).
- Splenectomie (zie ook Infectiepreventie/vaccinatie bij splenectomie en hyposplenisme); bij contra-indicatie voor chirurgie: miltbestraling (15).
- PM Splenectomie moet ook overwogen worden bij persisterende trombopene bloedingen, waar het lang duurt voordat de chemotherapie leidt tot herstel van de trombocyten.
Recidief HCL
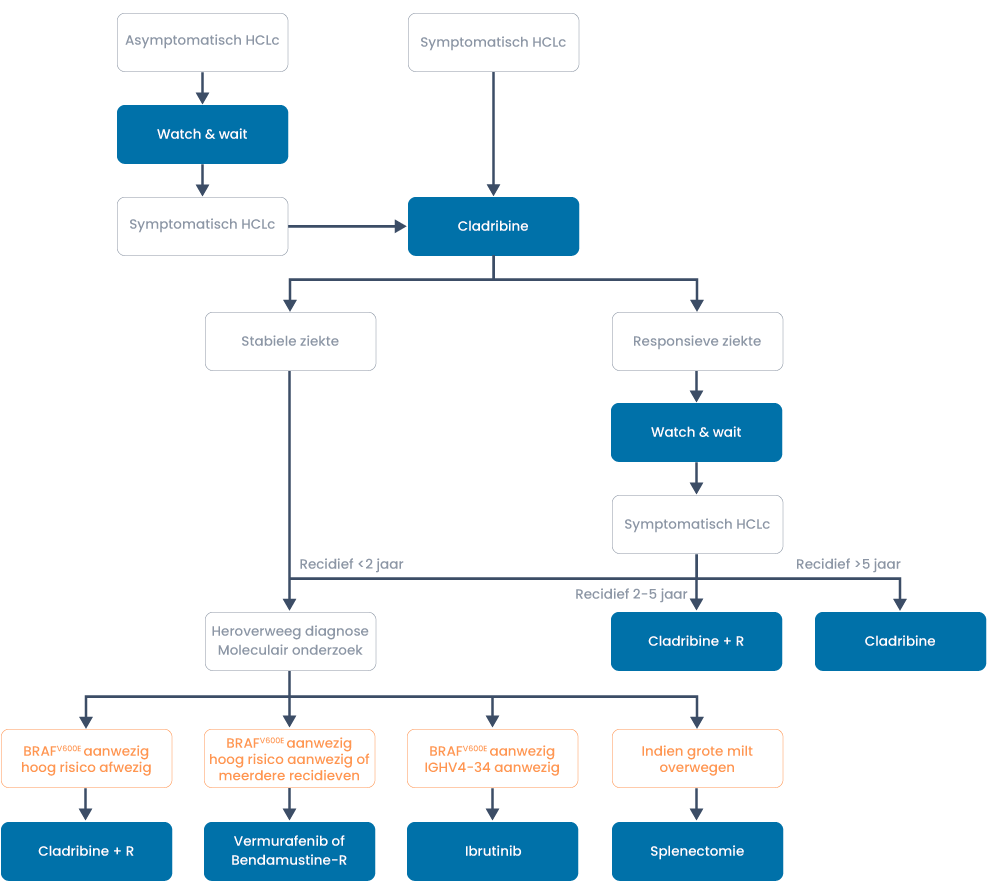
Recidief Klassiek HCL
Indicatie voor behandeling: trombocyten < 100 × 109/l, Hb < 6.0 mmol/l, granulocyten < 1 × 109/l of infecties, koorts recidiverende of ernstige infecties, klachten van splenomegalie, extreme vermoeidheid, gewichtsverlies > 10% in 6 maanden. Bij recidief > 5 jaar na initiële behandeling is hervatten van de initiële therapie (i.e. purine-analoog) de eerste keuze.
Bij een recidief 2-5 jaar na initiële behandeling kan opnieuw gestart worden met cladribine gevolgd door rituximab 8× 375 mg/m2 à 1 week (20).
Bij een recidief < 2 jaar moet de diagnose heroverwogen worden en bepaald worden of er hoogrisicofactoren aanwezig zijn.
Hoogrisicofactoren: ernstige anemie, massale splenomegalie, afwezigheid BRAFV600E, TP53-mutatie of del 17p, expressie IGHV4-34 rearrangement, ongemuteerd IGHV.
Aanbevolen diagnostiek
Beenmergaspiraat (of perifeer bloed bij dry tap), immunofenotypering, moleculaire diagnostiek (allel-specifieke PCR of NGS) BRAFV600E, del 17p, TP53-mutatie, IGHV4-34 rearrangement, IGHV mutatiestatus. Beenmergbiopt: morfologische beoordeling (hematoxyline-eosinekleuring, Gomori-kleuring) en uitgebreid immunohistochemisch onderzoek. Eventueel BRAFV600E– en TP53-mutatieonderzoek, indien geen ander materiaal beschikbaar.
Behandeladvies
Filter trials en protocollen voor dit ziektebeeld- BRAFV600E aanwezig en geen hoogrisicofactoren aanwezig: cladribine conform eerstelijnsbehandeling gevolgd door rituximab 8× 375 mg à 1 week.
- BRAFV600E aanwezig en hoogrisicofactoren aanwezig: overweeg vemurafenib 2 dd 960 mg tenminste 8 weken, maximaal 24 weken (streef 16-18 weken). Dosis aanpassen op geleide van bijwerkingen (19), alternatief bendamustine 90 mg/m2– rituximab à 4 weken, totaal 6 × (Burotto, 2013).
- Meerdere relapsen en BRAFV600E aanwezig: overweeg vemurafenib 2 dd 960 mg tenminste 8 weken, maximaal 24 weken (streef 16-18 weken). Dosis aanpassen op geleide van bijwerkingen (19), alternatief bendamustine 90 mg/m2– rituximab a 4 weken, totaal 6 ×.
- BRAFV600E afwezig en IGHV4-34 aanwezig of ongemuteerd IGHV (aparte entiteit, zie variant): overweeg ibrutinib 420 mg 1dd. Nog niet hiervoor geregistreerd.
- BRAFV600E aan- of afwezig en grote milt: overweeg splenectomie. Of miltbestraling als er contra-indicaties zijn voor splenectomie.
Responsbeoordeling
Er moet worden gestreefd naar maximale respons, zo mogelijk CR*. CR is haalbaar, maar de kans hierop hangt erg af van de definitie CR. Een beenmergbiopt met kleuring op CD20 is vereist. De remissieduur is lang, maar jarenlange follow-up laat na 15 jaar toch 35% recidieven zien, vooral als er initieel geen CR bereikt werd.
* Velen vinden het niet nodig te streven naar ‘echte’ CR omdat ook bij PR de ziekte jarenlang rustig kan blijven en een recidief opnieuw goed te behandelen is. Het percentage responders en de duur van de respons neemt echter geleidelijk af.
Responsbeoordeling 4-6 maanden na behandeling op basis van kliniek:
- Doel: induceren complete of partiële remissie
- Koorts, infecties, klachten van splenomegalie, vermoeidheid, gewichtsverlies
- Vastleggen miltgrootte
- Hb > 6.8 mmol/l, trombocyten > 100 × 109/l , neutrofielen granulocyten > 1.0 × 109/l
- Indien partiële respons of complete respons follow-up à 3-12 maanden
| Respons | Criteria voor respons |
| Complete remissie | Hb > 6.8 mmol/l, trombocyten > 100 × 109/l, neutrofiele granulocyten > 1.5 × 109/l. Normale milt bij lichamelijk onderzoek. Morfologische afwezigheid van HCL in perifeer bloed en beenmerg. |
| Complete remissie +/- MRD | Complete remissie + op beenmergbiopt immunohistochemische beoordeling van percentage HCL infiltraten. |
| Partiële remissie | Hb > 6.8 mmol/l, trombocyten > 100 × 109/l, neutrofiele granulocyten > 1.5 × 109/l, > 50% afname in organomegalie en > 50% afname in HCL infiltraten in beenmergbiopt. |
| Stabiele ziekte | Geen tekenen van remissie. |
| Progressieve ziekte | Toename van ziektesymptomen, 25% toename in organomegalie of 25% afname in perifere bloedwaardes (niet veroorzaakt door therapie). |
| Morfologisch recidief | Terugkeer van HCL in perifeer bloed en/of beenmerg zonder cytopenie. |
| Hematologisch recidief | Hb < 6.8 mmol/L, trombocyten < 100 × 109/l, neutrofiele granulocyten < 1.5 × 109/l. |
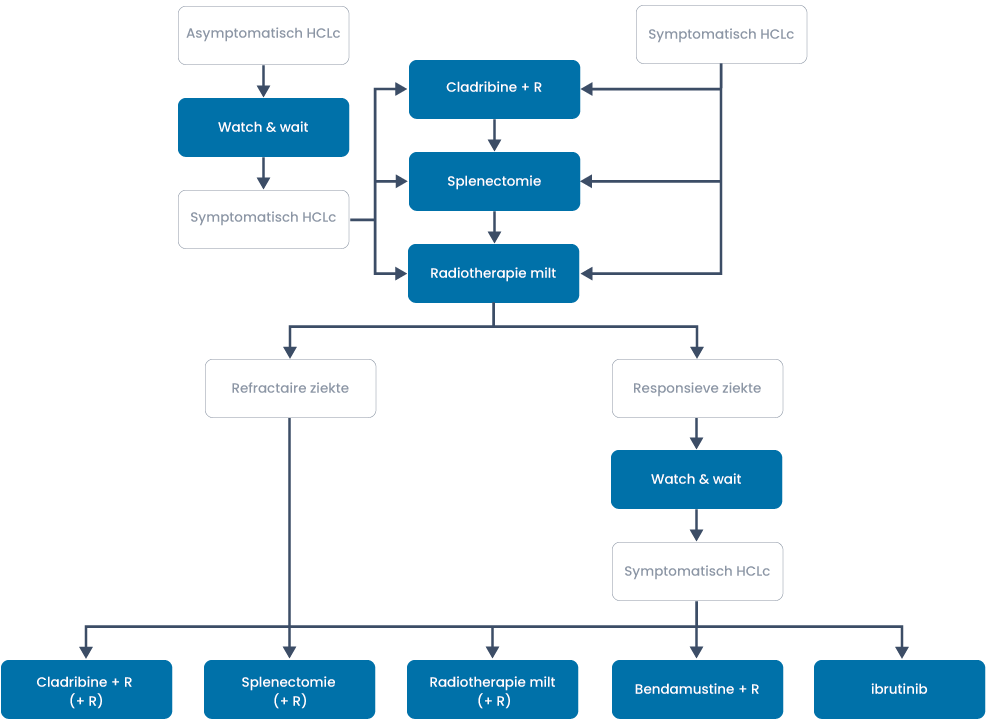
HCL variant (HCLv)
Dit zeer zeldzame ziektebeeld presenteert zich meestal met een uitgesproken leukocytose en lymfocytose waarbij de maligne cellen morfologisch en immunofenotypisch kenmerken hebben van hairy cellen (ze hebben uitlopers en vaak CD103 expressie, maar geen CD25) en prolymfocyten (grote centrale kern met opvallende grote nucleolus). De beenmerginfiltratie en miltinfiltratie is identiek aan die van HCL. Maar verder heeft het ziektebeeld niets met de klassieke HCL te maken, heeft geen BRAF-mutatie, en reageert over het algemeen ook niet op cladribine of interferon-alfa als monotherapie.
Eigenschappen
HCLv te onderscheiden door leuko- en lymfocytose, afwezigheid van monocytopenie, negativiteit voor CD25 en positiviteit voor CD24.
Variant HCL (HCLv) heeft geen BRAFV600E-mutatie.
Behandeling
Filter trials en protocollen voor dit ziektebeeldDe combinatie van 5 dagen cladribine met 8 wekelijkse giften rituximab zou in twee kleine series wel langdurige (mediaan circa 2 jaar) remissies geven (10, 2). Splenectomie (evt. gevolgd door 4 giften rituximab bij residuale ziekte (23)) resulteert bij twee derde van de patiënten in langdurige remissies (12). Incidenteel worden andere therapie-opties zoals fludarabine of alemtuzumab genoemd, terwijl aangegeven wordt dat de standaard alkylerende middelen niet werken. Gegevens over combinaties met bendamustine, laat staan ibrutinib, zijn er niet. De mediane overleving is in de ordegrootte van 9 jaar zonder enige vorm van plateau, dus veel minder goed dan van HCL. Een fraai overzicht van dit ziektebeeld is te vinden in Matutes et al, 2003.
In clinical trials is de activiteit van een first-in-class recombinant immunotoxine Moxetumomab pasudotox bij patiënten met recidiverende/refractaire HCL al aangetoond. Deze immunotoxine is nog niet in Nederland te krijgen.
Literatuurlijst
- Brunetti L, Di Noto R, Abate G, Gorrese M, et al. CD200/OX2, a cell surface molecule with immunoregulatory function, is consistently expresses on hairy cell leukaemia neoplastic cells. Br J Haematol. 2009 Jun;145(5):665-7.
- Chihara D, Kantarjian H, O’Brien S et al. Br J Haematol. 2016;174(5):760.
- Dearden, C.E., Else, M., Catovsky, D. Long-term results for pentostatin and cladribine treatment of hairy cell leukemia. Leuk Lymphoma 2011;52 Suppl 2:21-24.
- Dietrich, S., Glimm, H., Andrulis, M. et al. BRAF inhibition in refractory hairy-cell leukemia. New Engl J Med 2012;366:2038-2040.
- Dinmohamed A, Visser O, Posthuma W et al. Relative survival reaches a plateau in Hairy Cell leukemia (HCL): a population-based study on incidence, primary treatment and survival among 1,427 patients diagnosed in the Netherlands, 1989-2014. Poster EHA 2017.
- Grever, M.R. How I treat hairy cell leukemia. Blood 2009; 115, 21-28.
- Grever MR, Blachly JS, Andritsos LA, et al. hairy cell leukemia: update on molecular profiling and therapeutic advances. Blood rev. 2014 sep;28(5):197-203.
- Grever MR, Abdel-Wahab O, Andritsos LA, et. al. Consensus guidelines for diagnosis and managment of patients with classic hairy cell leukemia. Blood 2017 feb 2;129(5):553-560.
- Hagberg, H., Lundholm, L. Rituximab, a chimaeric anti-CD20 monoclonal antibody, in the treatment of hairy cell leukaemia. Brit J Haematol 2001, 115, 609-11.
- Kreitman RJ, Wilson W, Calvo KR et al. Cladribine with immediate rituximab for the treatment of patients with variant hairy cell leukemia. Clin Cancer Res 2013, 19, 6873-6881.
- Lauria, F., Cencini, E., Forconi, F. Alternative methods of cladribine administration. Leuk.Lymphoma 2011, 52 Suppl 2:34-7.
- Matutes E, Wotherspoon A, Catovsky D. The variant form of hairy-cell leukaemia. Best Pract Res Clin Haematol 2003, 16, 41-56.
- Quesada, J.R., Reuben, J., Manning, J.T., et al. Alpha-interferon for induction of remission in hairy cell leukemia. N Engl J Med 1984, 310, 15-8.
- Robak, T., Jamroziak, K., Gora-Tybor, J., et al. Cladribine in a weekly versus daily schedule for untreated active hairy cell leukaemia: final report from the Polish Adult Leukemia Group (PALG) of a prospective, randomized, multicenter trial. Blood 2007, 109, 3672-5.
- Sharp, R.A., MacWalter, R.S. A role for splenic irradiation in the treatment of hairy-cell leukaemia. Case report and review of the literature. Acta Haematol 1983, 70, 59-62.
- Spiers, A.S.D., Parekh, S.J., Bishop, M.B. Hairy-cell leukemia: induction of complete remission with pentostatin (2′-deoxycoformycin). J Clin Oncol 1984, 2, 1336-42.
- Tallman, M.S., Hakimian, D., Kopecky, K.J., et al. Minimal residual disease in patients with hairy cell leukemia in complete remission treated with 2-chlorodeoxyadenosine or 2-deoxydoformycin and prediction of early relapse. Clin Cancer Res 1999, 5, 1665-70.
- Tiacci, E., Trifonov, V., Schiavoni, G., et al. BRAF mutations in hairy-cell leukemia. New Engl J Med 2011, 364, 2305-15.
- Tiacci E, Park JH, de Carolis L, et al. Targeting mutat BRAF in relapsed or refractory hairy-cell leukemia. N Engl J med. 2015 oct 29;373(18):1733-47.
- Thompson PA, Ravandi F. How I manage patients white hair cell leukaemia. Br J Heameatol 2017 May;177(4):543-556.
- Von Rohr, A., Schmitz, S.F., Tichelli, A., et al. Treatment of hairy cell leukemia with claribine (2-chlorodeoxyadenosine) by subcutaneous bolus injection: a phase II study. Ann Oncol 2002, 13, 1641-8.
- Westbrook, C.A., Golde, D.W. Autoimmune disease in hairy-cell leukaemia: clinical syndromes and treatment. Brit J Haematol 1985, 61, 349-56.
- Yoshida T, Mihara K, Sugihara S et al. Splenectomy followed by administration of rituximab is useful to treat a patient with hairy cell leukemia-variant. Ann Hematol 2013, 92, 711-713.




