Introductie
Polycythemia Vera (PV) behoort samen met essentiële trombocytose (ET) en primaire myelofibrose (PMF) tot de BCR-ABL1-negatieve myeloproliferatieve neoplasieën (MPN). Het betreft een klonale myeloproliferatieve afwijking van de pluripotente stamcel, zich uitend in een overproductie van alle drie de cellijnen. Daarnaast is er een verhoogd Hb, vaak is er ook een leukocytose en een trombocytose. Patiënten met PV hebben een verhoogd risico op het doormaken van trombo-embolische complicaties (1, 2).
Incidentie: 0,01-2,8 per 100.000 inwoners/jaar
Prevalentie: 4-5/10.000 inwoners
Mediane leeftijd bij diagnose: 60 jaar
| Major criteria |
|
| Minor criterium |
|
| Diagnose bij 3 major criteria of 2 major criteria + het minor criterium
Major criterium 2 is niet noodzakelijk indien er sprake is van een absolute erytrocytose (Hb > 11,6 mmol/l en/of Ht > 0,56 bij mannen; Hb > 10,3 mmol/l en/of Ht > 0,50 l/l voor vrouwen EN voldaan aan de andere criteria. |
Diagnostiek
Anamnese
Algemene klachten, m.n. vermoeidheid komt heel veel voor, vragen naar constitutionele symptomen, jeuk, erytromyalgie, hemorragische diathese, trombose (ook in VG) en cardiovasculaire risicofactoren en jicht. Patiënten met PV hebben vaak klachten die kwaliteit van leven beïnvloeden. Dit kan bij diagnose en follow-up vastgelegd worden met de MPN-SAF-vragenlijst (3).
Anamnese gericht op onderliggende oorzaken erytrocytose (roken, OSAS, cardio-pulmonale klachten, verblijf op hoogte, exogene androgenen en EPO en familieanamnese) en duur erytrocytose.
Lichamelijk onderzoek
Bloeddruk en pols, miltgrootte, tekenen erytromelalgia, pletorisch gelaat, rode pijnlijke handpalmen of voetzolen, cyanotische acra.
Laboratoriumonderzoek
Bloedbeeld met differentiatie en reticulocyten
Nier- en leverfunctie, LDH, urinezuur, ferritine, CRP
Glucose en lipidenprofiel
EPO-spiegel (voor start aderlatingen)
Mutatie analyse naar drivermutatie en BCR-ABL ter uitsluiting CML
Drivermutaties
- JAK2 V617F 95%
- JAK2 Exon 12 4-5%
Op indicatie Von Willebrand ristocetine cofactoractiviteit en antigeen bij bloedingsneiging of indien er ingrepen met hoog bloedingsrisico verricht gaan worden.
Oorzaken primaire en secundaire erytrocytose
Primair (EPO-spiegel verlaagd):
- Congenitaal: EPO-receptormutaties of LNK-mutaties
- Verworven: PV
Secundair (EPO-spiegel verhoogd):
- Congenitaal:
- Defecten ‘oxygen sensing pathway’
- Hb met verhoogde affiniteit voor O2 (p50-meting) zoals bishosphoglyeraat mutase-deficiëntie en cytocgroom b5 reductase-deficiëntie.
Overleg Richard van Wijk (UMCU) voor analyse (email: vanwijk@umcutrecht.nl).
- Verworven:
- Centrale hypoxie bijvoorbeeld t.g.v. roken, longziekten, rechts-links-shunt, hypoventilatiesyndromen, CO-intoxicatie, verblijf op hoogte
- Lokale hypoxie bijvoorbeeld t.g.v. nierarteriestenose, hydronefrose, nierfalen, ADPKD, post-niertransplantatie erytrocytose
- Pathologische EPO-productie t.g.v. neoplasmata
- EPO of androgenengebruik (4)
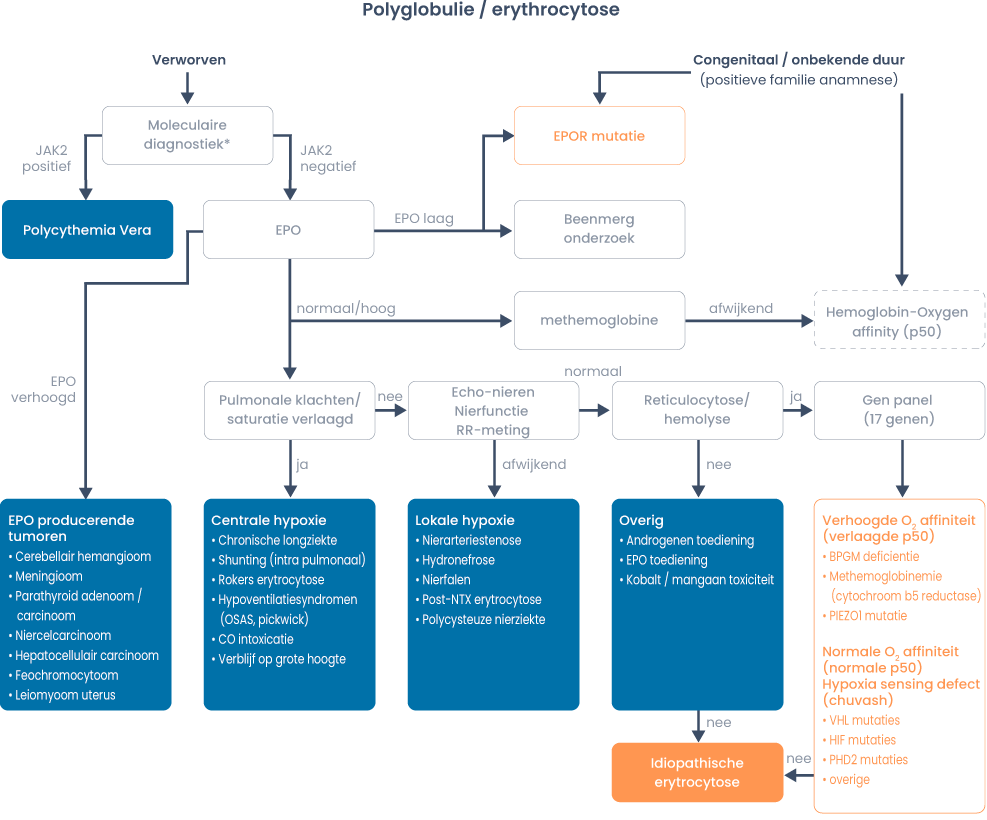
Figuur 1. Stroomdiagram erytrocytose (4)
Aanvullend onderzoek
Op indicatie:
- Beenmergaspiraat inclusief ijzerkleuring, beenmerghistologie en cytogenetica is aan te bevelen; mate van fibrose bij diagnose is belangrijk (eventuele progressie naar post-PV myelofibrose is prognostisch van belang)
- Echo abdomen ter bepaling splenomegalie
- Verwijzing slaapcentrum/KNO/longgeneeskunde/cardiologie (ook mengvormen mogelijk)
- Cytogenetisch onderzoek indien geen drivermutatie aangetoond of verdenking MDS
Risicoclassificatie en Prognose
Risicoclassificatie (5)
| Risicofactoren | Leeftijd ≥ 60 jaar
Eerdere trombo-embolische complicatie Leukocytose > 15 × 109/l |
| Standaard | Geen van bovenstaande risicofactoren |
| Hoog | ≥ 1 risicofactor |
Prognose
- Mediane overleving 15 jaar; patiënten < 40 jr mediane overleving 37 jaar (6).
- 10-jaarsrisico transformatie naar AML ca. 3% (6).
Behandeling
Filter trials en protocollen voor dit ziektebeeld- Trombocyten aggregatieremming
- acetylsalicylzuur 80 mg of carbasalaatcalcium 100 mg, advies om dit ’s avonds in te nemen
- tenzij hemorragische diathese of VvWD; dan eerst cytoreductie
- Flebotomie met streef Ht < 0,45 l/l
- Bestrijding cardiovasculaire risicofactoren zoals hypertensie, hypercholesterolemie, diabetes mellitus en roken
Cytoreductieve therapie (5, 6)
Doel: verminderen risico (nieuwe) trombo-embolische complicaties door bereiken normaal Ht. Ook vermindering van hinderlijke PV-symptomatologie of te frequente flebotomieën (≥ 3/jaar) is een indicatie voor cytoreductie.
| Indicaties cytoreductie | Behandeldoel |
| Hoog risico PV | streef Ht < 0,45 l/l |
| Trombocyten > 1500 × 109/l of VWD | |
| Symptomatische splenomegalie | |
| PV-gerelateerde symptomen | |
| Te frequent of slecht verdragen flebotomieën | |
| Progressieve myeloproliferatie | streef Ht < 0,45 l/l, trombocyten < 400 × 109/l en leukocyten < 15 × 109/l |
Aanvullende maatregelen:
- overweeg allopurinol 1dd 300 mg bij verhoogd urinezuur of bekend met jicht
Eerste lijn
| Hydroxycarbamide | startdosering 1dd 500-1000 mg p.o. |
| Peginterferon alfa-2a | startdosering 45-90 mcg/week s.c. |
Tweede lijn
| Hydroxycarbamide | startdosering 1dd 500-1000mg p.o. |
| Peginterferon alfa-2a | startdosering 45-90 mcg/week s.c. |
Ruxolitinib
|
startdosering 2dd 10 mg, dosering aanpassen o.g.v. therapeutisch effect en streef trombocyten > 100 × 109/l. Maximale dosering 2dd 25 mg. |
Anagrelide
|
stardosering 2dd 0,5 mg, wekelijks verhogen met 0,5 mg/dag o.g.v. trombocytengetal. Maximale dosering 10 mg/dag en 2,5 mg/gift. |
| Combinatie van bovenstaande behandelingen |
* inadequaat therapeutisch effect cytoreductieve therapie:
- onvoldoende reductie Ht of trombocyten/leukocyten-aantal
- onvoldoende effect op symptomatische splenomegalie of invaliderende jeuk
- intolerantie voor hydroxycarbamide
- ernstige vermoeidheid die gerelateerd is aan PV
- het ontstaan van ulcera aan de benen of andere graad 3-4 toxiciteit van de behandeling
** het niet bereiken van een adequaat therapeutisch effect bij een dosering van ≥ 2 g/dag gedurende 12 weken therapie, OF indien het beoogde therapeutisch effect niet bereikt wordt bij een maximaal te tolereren dosering van < 2 gram/dag (6).
Bijzonderheden/specifieke aandachtspunten, ziekte/behandeling-gerelateerd
Hydroxycarbamide (HU) en peginterferon alfa zijn gelijkwaardige eerstelijnsbehandelopties. De keus is afhankelijk van patiëntfactoren en -wensen en dient door de behandelaar samen met de patiënt besproken te worden (6).
Hydroxycarbamide geeft over het algemeen snellere hematologische responsen dan peginterferon alfa. Echter, een gerandomiseerde studie op de langere termijn laat wel voordelen zien van langwerkend interferon boven HU, zoals het significant verlagen van de Jak2 load (moleculaire response) waarmee de ziekte uiteindelijk milder wordt en een significant hoger percentage complete hematologische respons t.o.v. HU-gebruikers na 3 jaar; resp. 53% versus 38% (8). Ook een toename van huidcarcinomen op de langere termijn is in de praktijk een issue bij langdurig HU-gebruik.
Hydroxycarbamide (HU)
- Kortetermijnbijwerkingen: megaloblastaire anemie, leukopenie, stomatitis, fototoxiciteit (factor 50 zonlichtbescherming te allen tijden), cutane vasculitis, huiduitslag en erytheem, maagpijn en diarree.
- Langetermijnbijwerkingen: beenmergfalen, secundaire leukemie, non-melanoma huidkankervormen, vereist jaarlijkse volledige huidcontrole door huisarts of dermatoloog.
Peginterferon alfa-2a
- Bijwerkingen: Griepachtige verschijnselen (passagière), vermoeidheid, anorexie, algehele malaise, slapeloosheid, artralgie, jeuk en alopecia, en zeldzaam: depressie en angst met verhoogd suïciderisico.
- Aandachtspunten:
- Voor en tijdens behandeling controle TSH/FT4;
- ECG bij cardiale voorgeschiedenis;
- Wees voorzichtig bij patiënten met auto-immuunziekten of voorgeschiedenis hiervan.
Ruxolitinib (9)
- Bijwerkingen: hypertensie, verhoogde bloedingsneiging, gewichtstoename, hypercholesterolemie, anemie en trombopenie
- Aandachtspunten:
- Medicatie niet abrupt staken i.v.m. ‘onttrekkingssyndroom’
- Interactie met sterke/matige CYP3A4-remmers of tweevoudige remmers van CYP2C9 en CYP3A4
- Overwegen screening TBC
- Verhoogd risico herpes zoster-reactivatie; goed uitleggen hoe te handelen!
Anagrelide
- Bijwerkingen: hoofdpijn, palpitaties, algehele malaise, oedemen, diarree, flatulentie, misselijkheid, buikpijn, huiduitslag en vertigo.
- Aandachtspunten:
- ECG (en eventueel echocardiografie) voor start behandeling i.v.m. cardiotoxiciteit en QT-tijd verlenging
- trombocyten aggregatieremming tijdens zwangerschap
- profylactische dosering LMWH kraambed (6 weken) indien geen extra risicofactoren
- profylactische dosering LMWH gehele zwangerschap + kraambed indien wel risicofactoren
- Trombose of bloeding in voorgeschiedenis
- Voorgeschiedenis ≥ 3 miskramen 1e trimester, miskraam 2e/3e trimester, intra-uterine sterfte, pre-eclampsie < 37 wk, intra-uterine groei-achterstand of aanwijzingen placentadysfunctie
- Eerdere zwangerschap met bloeding of post-partumbloeding met transfusienoodzaak
- Abnormale flow uterine arteriën huidige zwangerschap
- Vooraf of tijdens huidige zwangerschap trombocyten > 1000×109/l
- therapeutische dosering LMWH gehele zwangerschap + kraambed bij reeds gebruik antistollingstherapie voor de zwangerschap
- streef Ht < 0,45 l/l en trombocyten < 1000 × 109/l middels flebotomie en/of peginterferon alfa-2a indien geen extra risicofactoren
- streef Ht < 0,40 l/l en trombocyten < 400 × 109/l middels flebotomie en/of peginterferon alfa-2a indien wel extra risicofactoren
Follow-up
Stadia van PV in chronologie:
- Initiële polycythemische ofwel proliferatieve fase met verhoogd Hb en Ht, meestal in combinatie met leukocytose en trombocytose
- Stabiele fase met stabiele of minder behoefte aan therapie en normaal bloedbeeld
- 10-30% overgang naar spent fase met vaak post-polycythemische (post-PV) myelofibrose met progressieve splenomegalie en pancytopenie met leuko-erytroblastose. Hierbij worden traandruppelcellen en blasten in perifeer bloed gezien in combinatie met een verhoogd LDH
- Vanuit spent fase ca. 25% transformatie naar AML, al of niet via overgang MDS
Na 5 jaar behandeling voor PV is een nieuw beenmerg aan te bevelen, zeker indien er bij diagnose tekenen waren van enige reticuline fibrose. Indien fibrose-gradering is toegenomen is peginterferon alfa-2a te (her)overwegen als therapie of de dosis te verhogen om de mate van fibrose toename af te remmen cq. de mate van fibrose te stabiliseren of terug te dringen (10). Ook is de Jak2 load te vervolgen (elke 2 jaar onder peginterferonbehandeling). Deze kan lager worden onder peginterferontherapie (8), hetgeen betekent dat de activiteit van de ziekte afneemt. Dit kan de prognose in gunstige zin beïnvloeden.
Literatuurlijst
- Khoury JD et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms. Leukemia 2022;36:1703-19.
- Arber DA, et al.International Consensus Classification of Myeloid Neoplasms and Acute Leukemias: integrating morphologic, clinical, and genomic data. Blood 2022;140(11): 1200–1228.
- Emanuel RM, Dueck AC, Geyer HL, et al. Myeloproliferative neoplasm (MPN) symptom assessment form total symptom score: prospective international assessment of an abbreviated symptom burden scoring system among patients with MPNs. J Clin Oncol. 2012 Nov 20;30(33):4098-103
- McMullin MF, Mead AJ, Ali S, et al. A guideline for the management of specific situations in polycythaemia vera and secondary erythrocytosis. Br J Haematol. 2018 Nov 13. doi: 10.1111/bjh.15647.
- Barbui T, Tefferi A, Vannucchi AM, et al. Philadelphia chromosome-negative classical myeloproliferative neoplasms: revised management recommendations from European LeukemiaNet. Leukemia. 2018 May;32(5):1057-69.
- Tefferi A, Barbui T. Polycythemia vera and essential thrombocythemia: 2021 update on diagnosis, risk-stratification and management. Am J Hematol. 2020 Dec;95(12):1599-1613. Doi: 10.1002/ajh.26008. Epub 2020 Oct 23.
- Harrison CN, Robinson SE. Myeloproliferative disorders in pregnancy. Hematol Oncol Clin North Am. 2011;25:261-75.
- Gisslinger H, Klade C, Georgiev P, et al. Ropeginterferon alfa-2b versus standard therapy for polycythaemia vera (PROUD-PV and CONTINUATION-PV): a randomised, non-inferiority, phase 3 trial and its extension study. The lancet Haematology 2020;7:196-208
- Vannucchi AM, Kiladjian JJ, Griesshammer M, et al. Ruxolitinib versus standard therapy for the treatment of polycythemia vera. N Engl J Med. 2015;372:426-35
- Marco Pizzi, Richard T Silver, Ariella Barel et al. Recombinant interferon-α in myelofibrosis reduces bone marrow fibrosis, improves its morphology and is associated with clinical response. Modern Pathology (2015) 28, 1315–1323