Introductie
In ons beenmerg bevinden zich de stamcellen die de productie van rode bloedcellen, bloedplaatjes en witte bloedcellen verzorgen. Deze stamcellen kunnen worden getransplanteerd. Voor deze transplantatie worden de termen beenmergtransplantatie en hematopoietische (bloed)(stam)celtransplantatie (HCT) nogal eens door elkaar gebruikt. Formeel wordt met beenmergtransplantatie bedoeld het transplanteren van stamcellen die zijn afgenomen bij de donor middels beenmergpuncties onder narcose op de operatiekamer. Met perifeer bloed hematopoietische (stam)celtransplantatie wordt bedoeld het transplanteren van cellen die worden verkregen door middel van een bij de donor onderhuids gespoten groeifactor waardoor de stamcellen vanuit het beenmerg naar het bloed worden gemobiliseerd. Deze kunnen dan vervolgens middels een zogenaamde afereseprocedure uit het bloed worden gefilterd. Tegenwoordig betreft meer dan 95 procent van de transplantaties het transplanteren van gemobiliseerde bloed(stam)cellen.
Hieronder wordt nader uitgelegd hoe de procedures voor deze behandelingen verlopen. Daarvoor is het ook nodig te begrijpen hoe chemotherapie werkt en waarom hoge doses gebruikt worden bij een deel van de transplantaties.
Bij chemotherapie en ook bij bestraling (radiotherapie) wordt een behandeling gegeven waarbij kwaadaardige cellen soms volledig, soms deels zullen worden gedood. Gezonde cellen zijn vaak beter bestand tegen chemo- en/of radiotherapie dan kwaadaardige cellen en zullen daardoor kunnen herstellen indien de gekozen dosis niet dodelijk is voor de gezonde cellen, terwijl bij deze dosis kwaadaardige cellen wel grotendeels kunnen worden uitgeschakeld. Bij ‘gewone’ chemotherapie wordt zo veel toegediend dat de reservefunctie van de bloedaanmaak intact blijft. Dit betekent dat er een grens is aan de hoeveelheid chemotherapie die gegeven kan worden. Soms zouden we méér willen geven om de kwaadaardige cellen beter te kunnen uitschakelen, maar dat kan niet, omdat dan het beenmerg met de gezonde stamcellen te veel zou worden beschadigd en er dus geen bloedaanmaak zal plaatsvinden.
De oplossing voor dit probleem bestaat uit het verzamelen van stamcellen, met het doel die vervolgens – na het geven van zeer intensieve chemo- en/of radiotherapie – te kunnen geven.
Verschillende soorten hematopoietische stamceltransplantatie (HCT)
Er zijn verschillende soorten stamceltransplantaties, onder andere afhankelijk van de donor van deze stamcellen:
- Autologe HCT (‘auto’ = zelf). Bij deze vorm van HCT krijgen patiënten hun eigen stamcellen terug die tijdelijk zijn opgeslagen in vloeibare stikstof. Zie voor meer informatie Autologe stamceltransplantatie.
- Allogene HCT (‘allogeen’ = vreemd). Bij deze vorm van HCT krijgen patiënten stamcellen van iemand anders. Zie voor meer informatie de animatie hieronder.
Bekijk hier de animatie over het donortraject.
Selectie van patiënten voor allogene HCT
Een allogene HCTwordt toegepast bij hoog-risico ziekten, meestal na behandelingen waarbij de ziektelast wordt beperkt. De behandeling maakt gebruik van gezonde afweercellen van een stamceldonor en is erop gericht de ziekte definitief onder controle te houden. De allogene HCT is een intensieve behandeling en hiervoor dienen patiënten in goede conditie te zijn, zowel lichamelijk (hart, lever, nieren en longen) als geestelijk. We zetten vooraf onderzoeken in om de conditie te optimaliseren voor de transplantatieprocedure; na transplantatie volgen regelmatige controles op de polikliniek. Dit is van groot belang om het risico op complicaties (infecties en orgaanschade) en overlijden te beperken.
Type stamcel donoren
Er zijn verschillende soorten allogene hematopoietische stamceltransplantaties ofwel allogene HCT. De belangrijkste verschillen betreffen de relatie tussen donor en ontvanger en de intensiteit van de voorbehandeling.
Als we kijken naar de relatie tussen donor en ontvanger zijn de volgende vormen van transplantatie mogelijk:
- Donor is verwant waarbij de transplantatie eiwitten volledig overeenkomen. Dit kan alleen het geval zijn bij een broer of zus (sibling).
- Donor is verwant waarbij een deel van de transplantatie eiwitten overeenkomen (zogenaamde haplo-identieke donoren (HAPLO = helft) denk aan broers, zusters of andere familieleden zoals ouders, kinderen, neven en nichten.
- Donor is niet verwant ( een zogenaamde Matched Unrelated Donor MUD). Bij deze allogene stamceltransplantatie is de donor geen familie van de ontvanger. De vrijwillige, niet verwante donor, heeft geheel of gedeeltelijk dezelfde transplantatie eiwitten als de ontvanger.
Transplantatie-eiwitten zijn een complex van eiwitten die gecodeerd worden door een complex van genen (HLA [Human Leucocyten Antigen]) in ons erfelijk materiaal.
Het vinden van een geschikte donor
Het zoeken van een geschikte donor is moeilijk en vraagt enige tijd. Daarom wordt er gelijk in het begin van de diagnose bloed afgenomen voor HLA- typering, zowel bij de patiënt als bij potentiële donoren. De potentiële donor moet jonger dan 70 jaar en gezond zijn. Behalve dat een donor (gedeeltelijk) dezelfde transplantatie genen moet hebben, moet een donor ook medisch goedgekeurd worden, voordat deze aangewezen kan worden als geschikte donor. Onderdelen van de medische keuring zijn: Beenmerg onderzoek, foto van de longen (thoraxfoto), Hartfilmpje (ECG), bloedonderzoek (o.a. van lever-, nierfunctie en virusinfecties). Wij vinden het zeer belangrijk dat de beslissing van de potentiële donor om inderdaad donor te zijn in alle vrijheid genomen kan worden. De medische keuring van de donor gebeurt daarom door een onafhankelijke internist/hematoloog en niet door de eigen hematoloog, die in de keuze mogelijk beïnvloed zou kunnen worden doordat hij/zij intens de patiënt begeleidt. Afhankelijk van de verrichte onderzoeken en het gesprek met de potentiële donor besluit de onafhankelijke internist/hematoloog of de potentiële donor een geschikte donor is. Als blijkt dat de potentiële donor van de patiënt een geschikte donor zou kunnen zijn, wordt de voorgestelde datum voor transplantatie definitief.
Het besluit welke donor uiteindelijk wordt gekozen ligt bij de artsen en transplantatie immunoloog van het transplantatieteam.
Een familiedonor (sibling = verzamelnaam voor broers en zussen)
Om een allogene HCT te kunnen ondergaan moet de patiënt een passende donor hebben. Een passende donor draagt dezelfde transplantatie-eiwitten op diens cellen als de ontvanger. De transplantatie-eiwitten zijn tien eiwitten die gecodeerd worden door tien genen (in ons erfelijk materiaal). Van deze tien genen zijn vijf afkomstig van de moeder en vijf van de vader. Als deze tien eiwitten en dus ook de coderende tien genen identiek zijn bij broer of zus en ontvanger, is de broer of zus een goede donor kandidaat. De kans dat iemands broer of zus een volledig geschikte donor is, is 25 procent. In dat geval zijn dus alle tien de transplantatiegenen hetzelfde. Als er geen volledig gematchte sibling donor wordt gevonden zal er gezocht worden naar een niet verwante donor (MUD) en als hier ook geen geschikte donor gevonden wordt behoort een HAPLO donor tot een mogelijkheid.(dit heet haplo-identieke transplantatie). Een verschil in bloedgroep tussen donor en ontvanger is niet bepalend of iemand wel of niet donor kan zijn.
Omdat kinderen vijf van de transplantatiegenen van hun vader en vijf van hun moeder krijgen, kunnen ouders en kinderen ook kandidaten zijn voor stamcel donatie voor hun kinderen of ouders. Zij zijn voor minimaal de helft identiek. Bij een HAPLO transplantatie komen de transplantatiegenen voor minimaal 50 procent overeen en als er geen HLA antistoffen zijn tegen de niet overeenkomende transplantatie genen, is deze donor(en) geschikt. Donor keuze wordt gemaakt door het transplantatie team gebaseerd op leeftijd, geslacht, bloedgroep en bepaalde aan- afwezige virussen zoals de CMV en EBV.
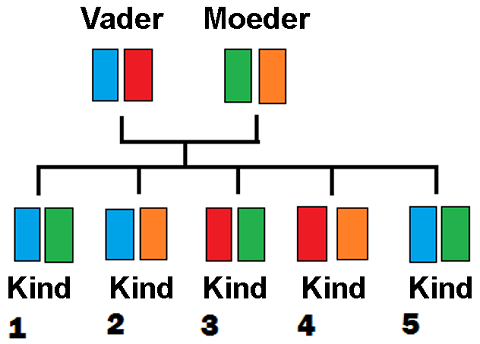
Een broer of zus heeft 25 procent kans om dezelfde transplantatie-eiwitten eiwitten (in dit voorbeeld: kinderen 1 en 5) te hebben en minimaal 50 procent op haplo-identiek (bijv. kinderen 1 en 2, maar ook 3 en 4, 2 en 4, 3 en 5, etc.).
Kinderen en ouders zijn 98% kans op HAPLO identiek. Onverwant heeft 75 procent kans om dezelfde transplantatie eiwitten te hebben.
Als er geen familiedonor beschikbaar is: onverwante donor (MUD-donor = Matched Unrelated Donor)
Als er geen volledig gematchte geschikte familiedonor is, dan kan in verschillende gegevensbestanden gezocht worden naar een andere, niet-verwante donor. De kans op het vinden van een geschikte donor hangt af van de etnische achtergrond. In het geval van een Europese achtergrond is de kans op het vinden van een volledig gematchte niet-verwante donor ongeveer 75 procent.
In sommige gevallen wordt er gekozen voor een niet volledige gematchte donor.
Tegenwoordig kan met moleculaire technieken zo nauwkeurig worden gekeken of iemand een geschikte donor is dat de uitkomst van een transplantatie met een goed passende niet-verwante donor bijna vergelijkbaar is met de uitkomst van een transplantatie met een volledig gematchte broer of zus als donor.
Op dit moment is de volgorde van de donorkeuze als volgt. In eerste instantie de keuze voor een volledig gematchte sibling, in tweede instantie een volledig gematchte onverwante donor en in derde instantie een haplo-identieke familiedonor. De laatste jaren is de behandeling met een haplo-identieke donor een stuk veiliger geworden. Het uiteindelijke bewijs dat een haplo-identieke donor even goede resultaten geeft als een volledig gematchte onverwante donor zal moeten worden geleverd uit een studie waarbij beide vormen van transplantatie direct worden vergeleken. Het UMCG zal ook deelnemen aan deze grote internationale studie.
Werking van allogene stamceltransplantatie (HCT)
Er zijn twee belangrijke redenen waarom een allogene HCT een effectieve manier is om een kwaadaardige ziekte te bestrijden. In de eerste plaats omdat bij een deel van de patiënten hoog gedoseerde chemotherapie of bestraling gegeven kan worden. We spreken in dit geval van een myeloablatieve allogene HCT. De chemotherapie en/of radiotherapie wordt dusdanig hoog gedoseerd dat de stamcellen in het beenmerg van de ontvanger kapotgemaakt worden, maar hopelijk ook door deze hoge dosering een sterke verlaging van de nog aanwezige tumorcellen. De getransplanteerde hematopoietische (stam)cellen zullen zorgen voor de vorming van nieuwe bloedcellen (van de donor) in de ontvanger.
In de tweede plaats – dit geldt voor zowel de myeloablatieve, als voor de transplantaties waarbij lagere dosis radiotherapie en/of chemotherapie wordt gebruikt (vaak gereduceerde intensiteit of non-myeloablatieve voorbehandeling genoemd) – omdat getransplanteerde donorcellen een afweerreactie tegen de achtergebleven tumorcellen hebben. Dit effect noemt men het ‘graft-versus-tumoreffect’. Dit wil zeggen dat de graft (het transplantaat), waarin afweercellen zitten, de tumorcellen aanvalt. Deze afweercellen afkomstig van de donor herkennen tumorcellen in het lichaam van de ontvanger (de patiënt) als vreemd en zullen deze willen vernietigen. We nemen aan dat op deze manier de afweercellen van de donor de tumorcellen die niet meer (of in mindere mate) gevoelig waren voor chemotherapie alsnog opruimen. Dit effect blijkt sterk te zijn en verklaart dat wanneer er geen hoge dosis voorbehandeling kan worden gegeven er toch genezing kan worden nagestreefd. Immers, bij deze vorm van geringe voorbehandeling is het anti tumoreffect bijna volledig afhankelijk van dit afweereffect (graft-versus-tumor).
Vóór de transplantatie
In de periode vóór de transplantatie wordt al gestart met de voorbereidingen om de transplantatie optimaal te laten verlopen. Zo wordt de patiënt verwezen naar de kaakchirurg om de mondholte en het gebit te laten beoordelen en mogelijke infectiebronnen uit te sluiten. Als er mogelijke bronnen voor infectie gezien worden, zal de kaakchirurg deze meestal behandelen. Dit kan bijvoorbeeld het verwijderen van een oude wortelrest betreffen, of het verwijderen van tandsteen.
In de periode voor de transplantatie moet al gestart worden met antibiotische bescherming in de vorm van co-trimoxazol (merknaam Bactrimel). Dit is met name om de longen zo veel mogelijk te behandelen tegen potentiële infectiebronnen in de toekomst. Ook wordt voor de transplantatie gestart met ursodeoxycholzuur (Ursochol). Dit wordt gegeven zodat de medicatie rond de transplantatie minder schade zal toebrengen aan de lever en de galwegen.
Als de patiënt bestraald gaat worden (voor informatie over de afdeling Radiotherapie, zie www.radiotherapiegroningen.nl), wordt deze in de periode voor de start van de voorbehandeling gezien door de radiotherapeut. Deze geeft informatie over de totale lichaamsbestraling en doet eventueel extra onderzoeken om bij hoge dosis de bestraling te kunnen geven met voldoende bescherming van de longen en ogen.
De voorbehandeling (conditionering)
Er zijn verschillende vormen met betrekking tot de intensiteit van de voorbehandeling
- myeloablatieve voorbehandeling.
- RIC (‘reduced intensity’ conditionering)
- non-myeloablatieve voorbehandeling
Myeloablatieve voorbehandeling
Bij een myeloablatieve voorbehandeling krijgt de ontvanger (de patiënt) vlak voor de transplantatie een zware chemotherapie of een combinatie van chemotherapie en radiotherapie of alleen radiotherapie (totale lichaamsbestraling) toegediend. Het doel van deze voorbehandeling is om (nogmaals) een grote hoeveelheid cellen te doden, zodat de eventueel nog aanwezige laatste tumorcellen gereduceerd worden. Deze zware celdodende behandeling maakt echter ook het beenmerg met de hematopoietische (stam)cellen kapot, zodat deze niet meer kunnen uitrijpen tot normale bloedcellen. De ontvanger heeft de donor stamcellen nodig om nieuwe bloedcellen te kunnen aanmaken. Behalve dat de voorbehandeling een direct celdodende werking heeft op o.a. de gezonde bloedvormende cellen van de ontvanger, heeft de transplantatie met donorcellen ook effect op eventueel nog aanwezige tumorcellen doordat de donorcellen een afweerreactie geven tegen deze tumorcellen (afweereffect) (zie Werking van allogene HCT).
Of deze zware voorbehandeling kan worden gegeven hangt af van een aantal factoren waaronder de biologische leeftijd van de patiënt en met name hart- en longfunctie. Ook de ziekte voorgeschiedenis telt mee om te zien of deze zware behandeling niet te belastend is. Patiënten die bijvoorbeeld al eens een autologe stamceltransplantatie hebben gehad, komen in de regel ook niet voor een myeloablatieve voorbehandeling in aanmerking.
RIST voorbehandeling
Bij een RIST (reduced intensity stemcell transplantation) voorbehandeling wordt er minder zware chemotherapie gegeven dan bij de myeloablatieve voorbehandeling, maar zwaarder dan bij de non-myeloabatieve voorbehandeling. Het doel van deze voorbehandeling is om (nogmaals) zoveel mogelijk tumor cellen te doden. Deze celdodende behandeling verwijdert de hematopoietische (stam)cellen niet volledig, zodat deze uiteindelijk weer zouden kunnen uitrijpen tot normale bloedcellen.
Behalve dat de voorbehandeling een direct celdodende werking heeft, heeft de transplantatie met donorcellen ook effect op nog aanwezige bloedvormende cellen in het beenmerg en ook tumorcellen doordat de donorcellen een afweerreactie geven tegen deze beide typen cellen (afweereffect) (zie Werking van allogene HCT). Behalve dat de voorbehandeling iets minder intensief is, is de rest van de transplantatie vergelijkbaar met de myeloablatieve transplantatie.
Non-myeloablatieve voorbehandeling
Bij een non-myeloablatieve voorbehandeling krijgt de ontvanger minimale chemotherapie en een lichte eenmalige totale lichaamsbestraling. Deze behandeling heeft nauwelijks celdodende eigenschappen en zal daarom ook weinig direct effect hebben op eventueel nog aanwezige tumorcellen in de patiënt. De werkzaamheid van deze vorm van transplantatie is grotendeels gebaseerd op het afweereffect (zie Werking van allogene HCT). Het duurt ook wat langer voordat de bloedvorming helemaal is overgenomen door de donor. Behalve dat de voorbehandeling het minst intensief is, is de rest van de transplantatie vergelijkbaar met de myeloablatieve transplantatie.
Verzamelen van de (stam)cellen
Terwijl de patiënt bezig is met de voorbehandeling, begint het proces van verzamelen van de hematopoietische stamcellen bij de donor. Er bestaan 2 manieren voor het verzamelen van de hematopoietische stamcellen.
- Uit het Bloed. Het verzamelen gebeurt d.m.v. een aferesemachine. De stamcellen die zich in de bloedbaan van de donor bevinden worden door een centrifuge in de aferesemachine gescheiden van de andere bloedcellen en verzameld in een zak.
- Beenmerg: De hematopoietische stamcellen worden verzameld door multipele beenmergpuncties uit het bekken. Hiervoor gaat de donor onder narcose.

Stamcelverzameling door middel van stamcelaferese
Bij een niet-verwante donor vindt de afname van de hematopoietische (stam)cellen plaats in de omgeving waar de donor vandaan komt. Een speciale koerier brengt deze cellen, na afname, naar het UMCG. De cellen worden in principe de dag na aferese aan de patiënt gegeven. De donor blijft anoniem.
De transplantatie
De eigenlijke transplantatie is het toedienen van de hematopoietische (stam)cellen van de donor aan de patiënt. De stamcellen worden via een infuus toegediend en vinden direct hun weg vanuit het bloed naar het beenmerg van de ontvanger (de patiënt), waar ze kunnen gaan uitgroeien. Deze stamcellen worden gegeven na de voorbehandeling. De dag van stamcelinfusie wordt dag 0 genoemd. Hoewel de eigenlijke infusie van de stamcellen een relatief eenvoudige procedure is, is het een mijlpaal in de behandeling.
Stamcellen. Volume verschilt per donor en donorcentrum
Na de transplantatie
Bij myeloablatieve en reduced-intensity voorbehandeling
Bij een myeloablatieve voorbehandeling duurt het meestal ongeveer 3 weken totdat de getransplanteerde cellen ervoor kunnen zorgen dat de ontvanger weer rode bloedcellen, bloedplaatjes en witte bloedcellen gaan produceren. Deze cellen zijn dan afkomstig van de donor. Als de patiënt en de donor voor de transplantatie verschillende bloedgroepen hebben, krijgt de patiënt na de transplantatie uiteindelijk de bloedgroep van de donor.
Wanneer de patiënt met een myeloablatief schema is behandeld, blijft deze een aantal weken opgenomen. Deze weken in het ziekenhuis zijn niet gemakkelijk, want de zware kuur heeft vrijwel altijd bijwerkingen in de zin van moeheid, misselijkheid, verlies van de eetlust, kapotte slijmvliezen met een pijnlijke droge mond en vaak diarree. Tegelijkertijd moeten er veel verschillende medicijnen ingenomen worden. Dankzij de speciale centraal veneuze katheter (een infuus in een groot bloedvat, meestal onder het sleutelbeen) is het mogelijk om medicatie en voeding via de bloedbaan toe te dienen gedurende de periode dat een patiënt moeite met slikken heeft. Vanwege de lage bloedgetallen zijn regelmatig transfusies nodig van rode bloedcellen en bloedplaatjes. Vrijwel elke patiënt maakt een periode met koorts door, waarvoor medicatie (meestal antibiotica) nodig is.
Wij stimuleren dat de patiënt in een zo goed mogelijke conditie blijft, zowel lichamelijk als geestelijk. Dit is ook het moment dat de patiënt zelf een belangrijke rol speelt in zijn of haar ziekte. Hoe meer het lukt uit bed te blijven, te fietsen op de hometrainer die op de afdeling staat of in de kamer, maar ook om voor afleiding te zorgen door bijvoorbeeld de krant te lezen, het volgen van het journaal en dergelijke, des te sneller zal er herstel optreden. Om u verder te stimuleren om actief te blijven is de fysiotherapie aanwezig om activiteit te ontplooien.
De patiënt is ongeveer 4 tot 5 weken opgenomen en mag naar huis als het bloedbeeld voldoende hersteld is, er geen koorts is en hij of zij goed in staat is alle medicatie in te nemen. Na ontslag volgen wekelijkse controles op de polikliniek tot ongeveer honderd dagen na transplantatie. In deze periode of al eerder wordt de ziekte opnieuw geëvalueerd (via beenmergonderzoek, eventueel een CT-scan, et cetera). Het evaluatie tijdstip is afhankelijk van de ziekte geschiedenis en de status van de ziekte voor stamceltransplantatie. De regelmaat van poliklinische controles daarna is volledig afhankelijk van hoe het gaat en verschilt per individu. Over het algemeen zijn de poliklinische controles in het eerste jaar om de 2 tot 4 weken.
Bij non-myeloablatieve voorbehandeling
In principe is de patiënt één week opgenomen (van vrijdag tot vrijdag). Als de patiënt goed in staat is alle medicatie in te nemen, gaat hij of zij naar huis. Het eerstvolgende polikliniekbezoek is de volgende maandagochtend. Het verdere beleid is identiek aan wat hierboven beschreven is voor de andere typen voorbehandeling.
Ontslaggesprek
Als uw bloedbeeld zo is hersteld dat het veilig is om naar huis te gaan en u kunt de medicatie ook goed innemen, komt het moment dat u weer naar huis kunt. 1-2 dagen voor ontslag komt de verpleegkundige specialist of een van de verpleegkundig consulenten bij u langs voor een ontslaggesprek. Uw partner of de persoon die u aanwijst mag bij dit gesprek aanwezig zijn.
In dit gesprek kunt u vragen stellen met betrekking tot de stamceltransplantatie en de volgende onderwerpen worden met u besproken:
- De leefregels voor thuis
- Wanneer neemt u contact op met het UMCG
- Koorts, temperatuur is hoger dan 38 °C
- Misselijkheid en braken
- Geen medicatie kunnen inneme
- Diarree, bij meerdere keren waterdunne ontlasting
- Huiduitslag
- Geel worden van huid en/of het oogwit
- Medicatie
- Tacrolimus, sirolimus of ciclosporine. Bij een poliklinisch bezoek dient u deze medicamenten in te nemen ná het bloedprikken (voor de bepaling van een zgn. ‘dalspiegel’). U kunt dus het beste deze medicatie meenemen vanuit thuis om in te nemen na de bloedafname. De spiegelbepaling is erg belangrijk omdat een te hoge concentratie in het bloed uw nieren kan beschadigen.
- Co-trimoxazol of pentamidine (antibiotische profylaxe). Op het doosje van het medicament staat soms “KUUR AFMAKEN”. Dit geldt niet voor u. U dient dit medicament ten minste 1 jaar te gebruiken. Zorg dus op tijd voor een nieuw recept. Uw behandelaar bepaalt wanneer u kunt stoppen met dit medicament.
- Valaciclovir (antivirale profylaxe). Op het doosje van het medicament staat soms “KUUR AFMAKEN”. Dit geldt niet voor u. U dient dit medicament ten minste 1 jaar te gebruiken. Zorg dus op tijd voor een nieuw recept. Uw behandelaar bepaalt wanneer u kunt stoppen met dit medicament.
- Ursochol gebruikt u minimaal 100 dagen. Uw behandelaar bepaalt wanneer u kunt stoppen met dit medicament. Alle nieuwe medicatie voorgeschreven, door huisarts of een andere specialist, buiten de hematoloog om, moet afgestemd worden vanwege eventuele interacties
Complicaties
Graft-versus-host-ziekte (omgekeerde afstoting)
Een belangrijk mechanisme van het effect van een allogene stamceltransplantatie is het zogenaamde graft-versus-tumoreffect. Door dit mechanisme vallen de afweercellen van de donor de tumorcellen aan. Dit mechanisme is echter niet zo specifiek dat het onderscheid kan maken tussen tumorcellen en gewone cellen. Dit betekent dat behalve tumorcellen ook gezonde cellen van de patiënt kunnen worden aangevallen door afweercellen van de donor. Dit noemt men de graft-versus-host-ziekte: de graft (het transplantaat) valt de host (de gastheer) aan.
Er zijn twee vormen van de graft-versus-host- ziekte: de acute vorm en de chronische vorm.
Acute graft-versus-hostziekte (aGVHD)
Met name de huid, de darmen en de lever zijn gevoelig voor de acute graft-versus-hostziekte. Acute graft-versus-hostziekte van de huid kan zich manifesteren als lichte geïrriteerdheid in de vorm van rode/jeukende huid (vergelijkbaar met zonnebrand), tot ernstige rode/jeukende/pijnlijke huid tot het kapotgaan van de huid met blaarvorming. Acute graft-versus-host-ziekte van de darmen kan zich manifesteren als een lichte vorm van diarree tot ernstige, waterdunne diarree (liters!) met krampende buikpijn. Acute graft-versus-host-ziekte van de lever uit zich met name in laboratoriumafwijkingen van de lever en kan resulteren in geelzucht.
De acute graft-versus-host-ziekte zal vooral plaatsvinden in de eerste honderd dagen na transplantatie. Indien de immuunsuppressie langer is gegeven kan na het staken van dit middel er ook een acute GVHD ontstaan in een latere fase.
Als zich in het beloop van de transplantatie klinische verschijnselen voordoen die zouden kunnen passen bij acute graft-versus-host-ziekte, wordt frequent overgegaan tot verder onderzoek om de diagnose met behulp van weefselonderzoek vast te kunnen stellen. Dit betekent een huidbiopt, een darmonderzoek met biopten of een leverbiopt.
De ernst van de acute-graft-versus-host-ziekte bepaalt het soort behandeling. In geval van een beperkte aandoening aan de huid kan worden volstaan met een steroïdzalf. Als de situatie ernstiger is, wordt aan de standaard afweer onderdrukkende medicijnen prednison toegevoegd. Meestal lukt het hiermee de acute graft-versus-host-ziekte rustig te krijgen.
De kans op het optreden van een vorm van acute graft-versus-hostziekte is ongeveer 50 procent waarbij er bij de huidige conditioneringsschema’s minder ernstige vormen van de GVHD optreedt.
Chronische graft-versus-hostziekte (cGVHD)
Chronische graft-versus-host-ziekte manifesteert zich totaal anders dan de acute vorm. Veel voorkomende symptomen van chronische graft-versus-host-ziekte zijn droge ogen en een droge mond. Verder kunnen pigmentveranderingen van de huid en minder frequent verstijving van de huid voorkomen. In feite kunnen bijna alle organen in meer of mindere mate worden aangetast. Ongeveer 20 procent van de patiënten ontwikkelt chronische graft-versus-hostziekte. Voor het merendeel is dit ziektebeeld zeer subtiel en is hiermee goed te leven, echter bij een deel vermindert dit substantieel de kwaliteit van leven.
Chronische graft-versus-hostziekte is meestal de reden dat de afweer onderdrukkende medicijnen niet verder geminderd kan worden. Soms is de chronische graft-versus-host-ziekte zo hevig dat er juist meer afweer onderdrukkende medicijnen moeten worden toegediend. Als er een behandeling wordt gestart voor chronische graft-versus-hostziekte, is het van belang de afweeronderdrukkende medicijnen zeer langzaam af te bouwen (vaak in jaren). De aanwezigheid van chronische graft-versus-hostziekte verkleint overigens de kans op terugkeer van de oorspronkelijke ziekte.
Transplantatie Falen
Kan het gevolg zijn van onvoldoende aantallen getransplanteerde hemapoïetische stamcellen, van verminderde functie van hemapoïetische stamcellen door medicatie/infecties of bijvoorbeeld door een aanval van de eigen afweer tegen de getransplanteerde cellen.
Infecties
Naast de graft-versus-hostziekte zijn infectieuze complicaties het grote probleem van een allogene HCT. Daarom wordt aangeraden om contact met de hematoloog op te nemen bij een temperatuur van groter dan 38,5 graden. In het weekend kunt u de dienstdoende hematoloog bellen via het alemene nummer van het UMCG. (050 3616161)
Virusinfecties
De belangrijkste virusinfectie die kan optreden is de Cytomegalovirus (CMV)-infectie. De meerderheid van patiënten en donoren heeft ooit een CMV-infectie gehad. Deze infectie wordt vervolgens levenslang onder controle gehouden door ons afweersysteem. Als echter het afweersysteem wordt onderdrukt (door bijvoorbeeld medicatie), kan het virus opnieuw de kop opsteken. Dit wordt ook wel ‘reactivatie’ genoemd. Dit kan resulteren in CMV-ziekte (zoals longontsteking en darmontsteking). Daarom wordt tijdens de opname en bij elk polikliniekbezoek regelmatig gekeken of er aanwijzingen zijn voor reactivatie van het virus. Als dit zo is, nog zonder dat dit klachten geeft, wordt gestart met medicatie (valganciclovir [tabletten; merknaam Valcyte] of ganciclovir [via infuus]) om het virus te onderdrukken. Door de frequente, nauwkeurige controle en de aanwezigheid van effectieve medicijnen tegen dit virus wordt CMV-ziekte minder frequent gezien.
Verder wordt valaciclovir voorgeschreven om een koortslip of gordelroos te voorkomen. Dit dient men te gebruiken gedurende een jaar na allo en eventueel langer als de afweeronderdrukkende medicijnen langer zijn doorgezet.
Bacteriële infecties
Bij myeloablatieve voorbehandeling is er een grote kans op bacteriële infecties totdat de waarden van de afweercellen weer redelijk zijn hersteld. Daarom wordt preventief antibiotica gegeven. Ook bij non-myeloablatieve voorbehandeling wordt preventief antibiotica gegeven.
Als de patiënt prednison gebruikt (tegen acute of chronische graft-versus-host-ziekte), is er een toegenomen kans op bacteriële infecties. Daarom wordt in deze situatie ook frequent preventief antibiotica gegeven.
Gist- of schimmelinfecties
Bij voorbehandeling kan een patiënt een gist- of schimmelinfectie ontwikkelen. Ter preventie van gistinfecties wordt fluconazol gegeven in de periode tussen voorbehandeling en herstel van de witte bloedcellen. Met name als er veel afweer onderdrukkende medicijnen worden gebruikt, bijvoorbeeld ten tijde van acute graft-versus-host-ziekte, is een patiënt vatbaar voor het ontwikkelen van gist- en/of schimmelinfecties.
Late gevolgen
De belangrijkste gevolgen van de transplantatieprocedure op lange termijn hangen samen met de voorbehandeling. Een myeloablatieve voorbehandeling leidt bijna altijd tot onvruchtbaarheid, maar dit is niet in alle gevallen zo. Na de transplantatie worden de hormoonspiegels van de geslachtshormonen gecontroleerd en worden zo nodig hormonen bijgegeven.
De totale lichaamsbestraling in hoge dosering zoals die wordt gegeven tijdens de myeloablatieve voorbehandeling, kan resulteren in een vertraagde schildklierwerking. Dit wordt regelmatig gecontroleerd en zo nodig wordt schildklierhormoon bijgegeven.
Voor meer informatie, zie Late complicaties als gevolg van chemotherapie of radiotherapie.
Door alle behandelingen die u krijgt en hebt ondergaan is er een kleine kans dat er een nieuw kwaadaardige ziekte optreed. Daarom wordt u vervolgd op de lange termijn follow-up polikliniek.
Ook bestaat de kans dat uw ziekte weer actief wordt. Afhankelijk van de activiteit van uw ziekte en of medicatie en wel/geen actieve graft versus Host ziekte kan er besloten worden voor Donor Lymfocyten Infusie (DLI).
DLI
Soms kan het nodig zijn om in een periode na de transplantatie het transplantaat te versterken. Dit kan bijvoorbeeld zijn in het geval de ziekte weer actief wordt. De gebruikelijke methode om het transplantaat te versterken is het toedienen van afweercellen (lymfocyten). Deze afweercellen worden verkregen door middel van de aferese procedure, zoals die ook is toegepast om de stamcellen te verzamelen. Deze procedure noemen we donor lymfocyten infusie (DLI). Meestal worden er meer lymfocyten afgenomen dan nodig is voor de 1e gift DLI. Het overgeblevene wordt dan in porties ingevroren. Deze kunnen dan zo nodig in een latere fase worden toegediend.
Medicijnenlijst
Afweeronderdrukkende medicijnen
Wil een transplantatie succesvol zijn, dan is het belangrijk dat het transplantaat niet wordt afgestoten. Dit wil zeggen dat cellen van de ontvanger (de patiënt) de cellen van de donor (het transplantaat) niet aanvallen. Tevens is het belangrijk dat omgekeerde afstoting (waarbij cellen van de donor de ontvanger aanvallen) niet of in geringe mate plaatsvindt. Om dit evenwicht te bewaren zijn afweer onderdrukkende medicijnen nodig.
- Tacrolimus (merknaam Prograft)
Dit middel wordt vaak initieel via het infuus toegediend. Het tijdstip waarop gestart wordt met de tacrolimus is afhankelijk van de conditionering. Als de patiënt opknapt, kan de tacrolimus door middel van capsules/tabletten worden genomen (en kan het infuus stoppen). De belangrijkste bijwerkingen van tacrolimus zijn nierfunctiestoornissen, hoge bloeddruk, trillingen van de ledematen (tremoren) en afwijkingen aan de zouten in het bloed. De dosering van tacrolimus wordt gestuurd door de laagste bloedspiegel (de dalspiegel) en door de nierfunctie. Het is daarom van belang dat de tacrolimus in de ochtenddosis pas wordt ingenomen nadat bloed is afgenomen voor bepaling van de dalspiegel. Dit is met name belangrijk tijdens polikliniekbezoeken: de patiënt laat eerst bloed prikken en neemt vervolgens tacrolimus in. Aangezien dit een erg belangrijk medicijn is en er een goede verdeling over de dag van dit medicijn in het bloed moet zijn, moet tacrolimus worden ingenomen met tussenpauzen van ongeveer 12 uur (bijvoorbeeld ’s ochtends 9 uur en ’s avonds 21 uur). In principe wordt geprobeerd na enige tijd de tacrolimus te minderen en te stoppen (af te bouwen). Dit kan vroeg zijn (al na 28 dagen) of later afhankelijk van de aantoonbaarheid van ziekte na de transplantatie of bijvoorbeeld afhankelijk van het chimerisme (de verhouding van nog aanwezige bloedcellen van de ontvanger versus de donor). - Cyclofosfamide
Deze chemotherapeutisch medicatie wordt per infuus toegediend na stamceltransplantatie. Dit lijkt erg vreemd voor de patiënt. Het doel is de cellen (T-cellen)die verantwoordelijk zijn voor de acute graft-versus-host-ziekte zoveel mogelijk te elimineren. De T-cellen die u nodig heeft voor uw afweer en het anti-tumor effect blijven gehandhaafd. Ook de getransplanteerde stamcellen ondervinden geen tot weinig schade. Tijdens de Cyclofosfamide gift krijgt u een infuus, 4 liter/24 uur, om irritatie van de blaas door de cyclofosfamide te voorkomen. Er moet iedere 2 uur geplast worden en ’s nachts bestaat de kans dat u wakker gemaakt wordt om te plassen. - Mycofenolaat mofetil (MMF) (merknaam CellCept)
o Dit middel wordt de eerste maand als tabletten gegeven. De belangrijkste bijwerking van MMF is misselijkheid. Myfortic is een afgeleide van Mycofenolaat mofetil en wordt soms ook ingezet.
Bij het optreden van bijwerkingen wordt soms gekozen voor Ciclosporine (merknaam Neoral) of sirolimus (merknaam Rapamune) als vervanger voor tacrolimus.
Andere medicijnen
In de periode voor en na de transplantatie zijn er een aantal medicijnen dat de patiënt moet gebruiken. Deze worden hieronder besproken.
- Co-trimoxazol (merknaam Bactrimel)
Hiermee wordt ongeveer 2 tot 3 weken voor de transplantatie gestart in een dosering van tweemaal per dag 960 mg. Het doel is om bepaalde infectiebronnen die aanwezig kunnen zijn vóór de transplantatie alvast aan te pakken. Ten tijde van de voorbehandeling voor de teruggave van de stamcellen wordt dit middel gestaakt. Het middel wordt hervat vanaf dag +28. De dosering die dan gebruikt wordt is twee opeenvolgende dagen twee keer per dag 960 mg (makkelijkste is iedere zaterdag en zondag: twee keer per dag 960 mg). Hiermee wordt minimaal doorgegaan tot 6 maanden na het staken van alle afweer onderdrukkende medicijnen en ten minste tot een jaar na de allogene stamceltransplantatie. Als een patiënt geen co-trimoxazol verdraagt (bijvoorbeeld vanwege huiduitslag), kan worden overgegaan op één keer per 4 weken Pentamidine vernevelingen (inhalatie). In specifieke gevallen kan worden gekozen voor een andere medicijn. - Ursodeoxycholzuur (merknaam Ursochol)
Hiermee wordt gestart 2 tot 3 weken voor de transplantatie en dit middel kan worden gestaakt 3 maanden na de transplantatie. Ursodeoxycholzuur zorgt ervoor dat gal wateriger wordt, waardoor de galafvloed beter verloopt. Uit onderzoekingen is gebleken dat gebruik van dit middel rond transplantatie het risico op levercomplicaties verkleint. - Valaciclovir (merknaam Zelitrex)
Hiermee wordt vaak gestart bij de opname voor de voorbehandeling. Het doel van valaciclovir is om het optreden van herpesvirusinfecties (koortslippen en/of gordelroos) te voorkomen. Valaciclovir wordt gegeven tot 6 maanden na het staken van alle afweer onderdrukkende medicijnen en ten minste tot een jaar na de allogene stamceltransplantatie. - Multivitamine zonder ijzer
Om ervoor te zorgen dat de patiënt voldoende vitamines tot zich neemt, krijgt iedere patiënt standaard een vitaminetablet vanaf de start van de voorbehandeling.. Meestal kan dit ongeveer 3 maanden na transplantatie worden gestaakt. Omdat patiënten die een allogene stamceltransplantatie ondergaan meestal een vorm van ijzerstapeling (opeenstapeling van ijzer) hebben en omdat ijzerstapeling schade geeft aan de weefsels, mag de multivitaminetablet geen ijzer bevatten. - Ciprofloxacine (merknaam Ciproxin)
Dit is een antibioticum dat meestal wordt gegeven in de periode vanaf de voorbehandeling totdat de hoeveelheid witte cellen hersteld is. Dit betreft meestal 2 tot 3 weken. Dit middel wordt herstart bij veel prednisongebruik. - Fluconazol (merknaam Diflucan)
Dit is een anti-gistmiddel dat wordt gegeven in de periode vanaf de voorbehandeling totdat de hoeveelheid witte cellen hersteld is. Dit betreft meestal 2 tot 3 weken. Ook dit middel wordt herstart bij (veel) prednisongebruik. - Amoxicilline
Dit is een antibioticum dat soms gegeven wordt bij omgekeerde afstoting (van de huid) en langdurige behandeling met prednisolon moet worden gegeven. - Prednisolon
Prednisolon (kortweg ook prednison genoemd) is een afweeronderdrukkend geneesmiddel. In geval van graft-versus-host-ziekte is dit een heel geschikte medicijn. Afhankelijk van het type graft-versus-host-ziekte wordt prednison voorgeschreven in verschillende doseringen en tijdsduur. De belangrijkste bijwerkingen van prednison zijn: vollemaansgezicht, verhoging van de bloedsuikerwaarden, hoge bloeddruk, botontkalking, actiever worden, slechter slapen en afname van spierkracht.
Late gevolgen
De belangrijkste gevolgen van de transplantatieprocedure op lange termijn hangen samen met de voorbehandeling. Een myeloablatieve voorbehandeling leidt bijna altijd tot onvruchtbaarheid, maar dit is niet in alle gevallen zo. Na de transplantatie worden de hormoonspiegels van de geslachtshormonen gecontroleerd en worden zo nodig hormonen bijgegeven.
De totale lichaamsbestraling in hoge dosering zoals die wordt gegeven tijdens de myeloablatieve voorbehandeling, kan resulteren in een vertraagde schildklierwerking. Dit wordt regelmatig gecontroleerd en zo nodig wordt schildklierhormoon bijgegeven.
Voor meer informatie, zie Late complicaties als gevolg van chemotherapie of radiotherapie.
Door alle behandelingen die u krijgt en hebt ondergaan is er een kleine kans dat er een nieuw kwaadaardige ziekte optreed. Daarom wordt u vervolgd op de long term follow-up polikliniek.
Werkgerelateerde zaken
Veel patiënten hebben een baan en zouden graag zien dat zij na de behandeling(en) kunnen terugkeren in hun oude functie. Dit is in veel gevallen mogelijk, maar soms ervaren zij om uiteenlopende redenen dat dit niet mogelijk blijkt. Het beste advies dat wij kunnen geven is om goede en duidelijke afspraken te maken met uw werkgever en de bedrijfsarts, die beiden een belangrijke rol moeten spelen in het reïntegratieproces. Wij hebben de belangrijkste werkgerelateerde zaken samengevat in deze folder.
Vaccinatie
Vanaf 3 maanden na de transplantatie krijgt de ontvanger opnieuw vaccinaties, te weten: DKTP, Act-Hib, Hepatitus-B Meningokokkenvaccin type ACW135Y en B, Pneumokokkenvaccin en influenzavaccin. De eerste vaccinatie bestaat uit pneumocokken en Act-HIB, gevolgd door Meningokokken, DKTP en Hepatitis B. Iedere 5 jaar wordt het pneumokokkenvaccin nog herhaald. Er bestaat een indicatie voor een jaarlijkse influenzavaccinatie (‘griepspuit’). Deze geldt ook voor personen die samenleven met de patiënt (gezin). De griepspuit wordt gegeven bij de huisarts.
Bij reizen naar exotische gebieden moeten extra beschermende maatregelen worden genomen betreffende vaccinaties en malariaprofylaxe. Hiervoor dient men ruim tevoren contact op te nemen met de behandelend hematoloog. Deze kan besluiten de patiënt nog te laten adviseren door de infectiespecialist.
Kosten
De basis ziektekostenverzekering van de patiënt (ontvanger) vergoedt alle kosten voor de allogene HCT. Dit betreft ook de kosten van de donorkeuring, G-CSF, eventueel hotelverblijf van de donor, et cetera. De gemaakte reiskosten van de donor voor donatie worden door de verzekering van de donor vergoed.
Privacy
De gegevens met betrekking tot de transplantatie worden anoniem vastgelegd in de database van de EBMT( European Blood en Marrow Transplantation) en in onze eigen data base en kunnen gebruikt worden voor eventuele onderzoeken in de toekomst. Ook de gegevens van de donor worden vastgelegd. De gegevens van de patiënt en de donor zijn niet te herleiden. Het doel van het vastleggen van gegevens is het waarborgen en verhogen van de kwaliteit.
Informed consent
In het traject voor HCT zullen de behandelend arts, de hematoloog die betrokken is bij de transplantatie en de transplantatieverpleegkundige uitgebreid met de patiënt praten. Als deze een gefundeerde beslissing heeft kunnen nemen met betrekking tot vervolgbehandeling met een allogene HCT, dan zal hem of haar worden gevraagd een informed-consentformulier te tekenen. Door het tekenen van dit formulier geeft de patiënt aan goed geïnformeerd te zijn en in te stemmen met een allogene HCT.
Patiëntenvereniging
Stichting Hematon is een zeer actieve patiëntenvereniging voor stamceltransplantatiepatiënten. Zij houden geregeld lezingen door geheel Nederland.
Stichting Hematon
www.hematon.nl
Postbus 8152
3503 RD Utrecht
030 – 760 34 60
secretariaat@hematon.nl
Bereikbaar op werkdagen van 09.00 tot 16.00 uur
Oncologische revalidatie en psychosociale nazorg
Daarnaast is er voor patiënten die de behandeling achter de rug hebben en moeite hebben de draad weer op te pakken, de mogelijkheid gebruik te maken van een oncologisch revalidatieprogramma. Dit programma is op verschillende locaties in Nederland beschikbaar, onder meer ook in het UMCG, via het Centrum voor Revalidatie, locatie Beatrixoord. Voor een locatie bij u in de buurt zie www.revalidatie.nl Dit programma is gericht op het verminderen van klachten zoals vermoeidheid, inname voldoende voeding, pijn, angst en neerslachtigheid. Daardoor verbetert de kwaliteit van leven.
Nazorg: Het Behouden Huys
Het valt niet altijd mee om met een ziekte als kanker om te gaan. Er komt verschrikkelijk veel op je af. Eerst de klap van de diagnose, dan de vaak ingrijpende medische behandelingen. En hoe verder daarna? Hoe ga je bijvoorbeeld om met een veranderd lichaam, met vermoeidheid of een onzeker levensperspectief? Het kan daarom heel wenselijk zijn om na(ast) de medische zorg gebruik te maken van extra ondersteuning door Het Behouden Huys.
Het Behouden Huys is gelegen te Haren.
Het is een bijzondere plek waar kankerpatiënten en hun naasten onder professionele en vooral ook betrokken begeleiding stil kunnen staan bij de lichamelijke, psychische en sociale gevolgen van hun ziekte. Er is begeleiding mogelijk voor iedereen, ongeacht de leeftijd, ziektefase, prognose of het stadium van het ziekteproces.
Wilt u meer weten, zie dan: www.behoudenhuys.nl.
Patiëntenvereniging Hematon Trefpunt:
1e en 3e dinsdag vd maand van 14.00-16.00 uur in UMCG poli 20 in ruimte 21 op de 1e verdieping (naast de Stee).
Website van Hematon: www.hematon.nl
Website voor AYA zorg: patiënten tussen 18-35 jaar: https://ayazorgnetwerk.nl/
AYA lounge bij Fonteinstraat 20
Inloophuis voor (ex-)patiënten en hun naasten: het Hamelhuys (in Groningen en Zuidlaren).
www.hamelhuys.nl




