Inleiding
Acute myeloïde leukemie (AML) is een heterogene ziekte, die wordt gekenmerkt door klonale expansie van immature hematopoëtische cellen van de myeloïde reeks als gevolg van een blokkade in de normale uitrijping, leidend tot een excessieve toename van leukemische blasten. Als gevolg van verstoring van de normale hematopoëse kunnen anemie, trombocytopenie en leukopenie ontstaan, met daaruit voortkomende klinische symptomen.
In Nederland ontwikkelen circa 750-850 patiënten per jaar een AML. Bijna 50% van deze patiënten is ouder dan 70 jaar (IKNL-data: in 2016 was 44% van de 732 gediagnosticeerde AML patiënten ouder dan 70 jaar).
Definitie en WHO-classificatie
Definitie
De diagnose AML wordt gesteld bij:
- > 20% myeloïde blasten in bloed of beenmerg of
- De cytogenetische afwijkingen t (8;21), t (15;17) of inv (16) ongeacht het percentage blasten
Bijzonderheden in de telling:
- Bij >50% erytroide cellen wordt het aantal blasten geteld binnen alle kernhoudende cellen (en niet alleen binnen het ‘niet-erytroïde’ compartiment).
- Bij bijzondere vormen van AML geldt dat specifieke cellen in de telling als equivalent aan blasten beschouwd worden:
- APL: Abnormale promyelocyten;
- Monocytaire AML: promonocyten;
- Megakaryoblastenleukemie: megakaryoblasten
WHO-2016 classificatie subgroepen AML
| AML met kiembaan pre-dispositie (kiembaan pre-dispositie) | ||
| Zonder pre-existente ziekte of orgaan dysfunctie | ||
| AML met kiembaan CEBPA-mutatie | ||
| Myeloïde neoplasie met kiembaan DDX41 mutatie | ||
| Met pre-existente afwijking van de trombocyten | ||
| RUNX1 mutatie | ||
| ANKRD26 mutatie | ||
| ETV6 mutatie | ||
| Met dysfunctie van andere organen | ||
| GATA2 mutatie | ||
| Geassocieerd met syndromen van beenmergfalen | ||
| Geassocieerd met ziekten die veroorzaakt worden door afwijkende telomeerbiologie | ||
| JMMoL geassocieerd met neurofibromatosis, Noonan syndroom of Noonan syndroom-achtige ziekten | ||
| Geassocieerd met Down syndroom | ||
| AML met gedefinieerde genetische afwijkingen | ||
| NB: deze groep heeft altijd voorrang; relevant als er bv ook multilineage dysplasie is of in combinatie met een mutatie die op zichzelf een slecht risico betekent | ||
| t(8;21) (q22;q22) [RUNX1-RUN1T1] | ||
| t(15;17) (q22;q11-12) [PML-RARA] (acute promyelocytenleukemie) | ||
| inv (16) of t(16;16) (p13;q22) [CBFB-MYH11] | ||
| t(9;11) [MLLT3-KMT2A] | ||
| t(6;9) [DEK-NUP214] | ||
| inv(3) (q21.3q26) of
t(3;3) (q21.q26) [GATA2, MECOM (EVI1)] |
||
| t(1;22) [RBM15-MKL1] | ||
| Gemuteerd NPM1 | ||
| Bi-allelische CEBPA-mutaties | ||
| Provisioneel: AML met BCR-ABL1 en AML met gemuteerd RUNX1 | ||
| AML met myelodysplasie gerelateerde veranderingen | ||
| Dysplasie in ≥50% in 2 of meer cellijnen; met of zonder (bekende) voorafgaande MDS | ||
| De volgende cytogenetische afwijkingen | ||
| Complex karyotype (≥ 3 afwijkingen) | ||
| Ongebalanceerde afwijkingen | ||
| −7/ del(7q) | ||
| del(5q)/ t(5q) | ||
| i(17q)/ t(17p) | ||
| −13/ del(13q) | ||
| del(11q) | ||
| del(12p)/ t(12p) | ||
| idic(X)(q13) | ||
| Gebalanceerde afwijkingen | ||
| t(11;16) (q23.3;p13.3) | ||
| t(3;21) (q26.2;q22.1) | ||
| t(1;3) (p36.3;q21.2) | ||
| t(2;11) (p21;q23.3) | ||
| t(5;12) (q32;p13.2) | ||
| t(5;7) (q32;q11.2) | ||
| t(5;17) (q32;p13.2) | ||
| t(5;10) (q32;q21.2) | ||
| t(3;5) (q25.3;q35.1) | ||
| Therapie gerelateerde myeloïde neoplasie | ||
| Na eerdere alkylerende therapie en radiotherapie, leidt meestal tot 3q-, -5, – 7, +8, +21, e.a. | ||
| Na eerdere behandeling met epipodophyllotoxines en anthracyclines, vooral leidend tot breekpunten in 11q23 (KMT2A), soms tot t(8;21), t(15;17) of inv(16) | ||
| Overige (bv na cisplatinum) | ||
| Overige: AML niet anders te classificeren (AML NOS) | ||
| AML met minimale differentiatie | ||
| AML zonder uitrijping | ||
| AML met uitrijping | ||
| Acute myelomonocyten leukemie | ||
| Acute monocyten leukemie | ||
| Acute erytroïde leukemie | ||
| Acute megakaryocyten leukemie | ||
| Acute basofiele leukemie | ||
| Acute panmyelose met myelofibrose | ||
| Myeloïd sarcoom | ||
| Myeloïde proliferatie gerelateerd aan Down syndroom | ||
| Blastaire plasmacytoide dendritische cel neoplasie (BPDCN) | ||
| Acute leukemie van “ambiguous lineage” |
| Acute ongedifferentieerde leukemie |
| Mixed-phenotype acute leukemie (MPAL) met t(9;22) (BCR-ABL1) |
| MPAL met t(v ;11q23.3) (KMT2A) |
| MPAL, B/myeloïd, NOS |
| MPAL, T/myeloïd, NOS |
NB: in aanwezigheid van t(8;21), t(16;16), inv(16) of t(15;17) is er altijd sprake van AML, ook bij een MPAL fenotype.
Immunofenotypische criteria voor kenmerken van de verschillende lijnen:
- Myeloïde lijn: cyMPO (flowcytometrie, immunohistochemie, cytochemie); of monocytaire differentiatie (tenminste 2 van de volgende kenmerken: niet specifiek esterase (cytochemisch), CD11c, CD14, CD64, lysozyme)
- T-cel lijn: Sterk cyCD3 (met antistoffen gericht tegen CD3-epsilon keten); of CD3-expressie op celoppervlak
- B-cel lijn: Sterke CD19-expressie met tenminste nog een van de volgende sterk tot expressie gebrachte merkers: CD79a, cyCD22; of CD10; of zwakke expressie van CD19 met tenminste 2 van de volgende merkers sterk tot expressie gebracht: cyCD79a, cyCD22, of CD10
Diagnostiek
Dit hoofdstuk is als checklist uit te draaien
Anamnese
Volledige anamnese met speciale aandacht voor:
- Familiair voorkomen MDS/AML; familiair voorkomen van kankerpredispositiesyndromen, beenmergfalen, pre- existente trombocytenziekten
- Hematologische voorgeschiedenis (MDS, MPN)
- Medicatie, intoxicaties, eerdere behandeling met chemotherapie of radiotherapie
- Mogelijke familiaire, potentiële stamceldonoren (broers, zussen en kinderen)
Lichamelijk onderzoek
Volledige lichamelijk onderzoek met speciale aandacht voor:
- Huidafwijkingen (petechiën, hematomen, chloromen/leukemia cutis, Sweet syndroom en erythema nodosum), lymfadenopathie, splenomegalie, gingivahypertrofie, testisvergroting, koorts, mond/gebit, infectiehaarden w.o. perianale regio, hoofdpijn en neurologische uitval
- Afwijkingen geassocieerd met erfelijke aanleg voor leukemie: wratten, lymfoedeem, vroege grijsheid, afwijkingen mondslijmvlies/nagels, hypo-/hyper pigmentatie huid, leukoplakie
- Performance status (WHO)
- Fundoscopie bij verdenking op hyperviscositeit (bv bij WBC> 100 x 109/L) en bloedingen
Laboratoriumonderzoek
Bloed
- Hb, MCV, Leukocyten (inclusief differentiatie), Trombocyten, Reticulocyten, Haptoglobine
- Kreatinine, Urinezuur, Natrium, Kalium, Calcium, Fosfaat, Magnesium
- ALAT, ASAT, Bilirubine, AF, gGT
- CRP, Glucose
- PT, APTT, fibrinogeen en D-dimeren (altijd)
- Bloedgroeptypering (bij nieuwe patiënten 2x)
- HLA-typering: klasse I (A/B/C) (bij indicatie allo HCT en indien HLA antistoffen met refractair zijn op trombocytentransfusie)
- HLA-typering: klasse II (DR/DQ) (bij indicatie allo HCT)
- HLA-typering: hoge resolutie (bij indicatie allo HCT)
- bij dry trap bij beenmergaspiratie: morfologie, immunofenotypering, cytogenetica en moleculaire diagnostiek op perifeer bloed verrichten
Serologie:
- Virus: HIV, HBV, HCV, CMV, EBV, HSV, VZV
- Lues, toxoplasmose (op indicatie)
- Bij reizigers of patiënten uit endemische gebieden: overweeg specifieke diagnostiek naar tuberculose, strongyloïdes, schistosomiasis
Microbiologie:
- SDD / surveillance kweken (naar lokaal gebruik)
Urine:
- Op indicatie urine screening en sediment
Beenmergonderzoek
Cytomorfologie
Immunofenotypering inclusief LAIP bepaling
- Precursormerkers: CD34, CD117, CD33, CD13, HLA-DR
- Granulocytenmerkers: CD65, MPO
- Monocytenmerkers: CD11b, CD11c, CD14, CD36, CD64
- Megakaryocytenmerkers: CD41, CD61
- Erytrocytenmerkers: CD235a (glycoforine), CD36, CD71
- Lymphoidemerkers: CD3, cyCD3, CD19, cyCD79a, CD10, cyCD22, CD56, CD7, cyIgM en sIgM, TdT
Cytogenetica
Moleculaire diagnostiek
Pathologie
Biobank/ Studiemateriaal
Overig onderzoek
- ECG (let op QT-verlenging)
- X-thorax
Met name als intensieve therapie wordt overwogen:
- Longfunctie: op indicatie
- Cardiale ejectiefractie: op indicatie
- ICC Kaakchirurgie: op indicatie
- CT-sinus of ICC KNO (op indicatie)
- LP (bij neurologische klachten, extra-medullaire manifestaties en hyperleukocytose – zie ook module 8.1)
- HCT-CI volgens Sorror
- Op indicatie: geriatrische en cognitieve evaluatie
- Fertiliteitsonderzoek/ -preservatie (bij intensieve therapie en jonge leeftijd)
- Semencryopreservatie
- ICC Gynaecoloog: fertiliteitsadvisering/counseling; zie richtlijn fertiliteitsbehoud bij vrouwen met kanker (https://richtlijnendatabase.nl/richtlijn/fertiliteitsbehoud bij vrouwen met kanker/tumorspecifieke interventies/hemato oncologie/acute myeloide leukemie.html)
- Moleculair onderzoek naar genetische predispositie als daar in de anamnese of bij lichamelijk onderzoek aanwijzingen voor bestaan (https://richtlijnendatabase.nl/richtlijn/fertiliteitsbehoud_bij_vrouwen_met_kanker/fertiliteitsbehoud_vrouwen_met_kanker_-_startpagina.html)
Diagnostiek ter evaluatie van de behandeling
Beenmergonderzoek
- na 1e intensieve behandeling tussen dag 15 -28 (+2 dagen)
- responsevaluatie bij re-populatie (in de praktijk vaak rond dag 28) of bij uitblijven van re-populatie uiterlijk op dag 35 (na 1e inductie kuur: morfologie;
- na 2e inductiekuur: morfologie, immunofenotypering, moleculair onderzoek afhankelijk van afwijkingen bij diagnose (ter bepaling van MRD), eventueel bij eerdere afwijkingen cytogenetica, bij persisterende aplasie ook beenmergbiopt.
NB: Na hypomethylerende therapie (met name bij 10 dagen decitabine) eerste beenmergonderzoek op dag 28 (+/- 3 dagen). Bij azacitidine is de behandeling pragmatisch en wordt vooral gevaren op het perifere bloedbeeld.
Diagnostiek bij recidief
In principe volledige beenmergdiagnostiek (inclusief moleculaire afwijkingen, die potentiele behandelconsequenties hebben).
Risicoclassificatie en Prognose
Risicoclassificatie volgens ELN 2017
| Risicogroep | Genetische afwijkingen |
| Gunstig | t(8;21)(q22;q22.1); RUNX1-RUNX1T1 inv(16)(p13.1q22) or t(16;16)(p13.1;q22); CBFB-MYH11 gemuteerd NPM1 zonder FLT3-ITD of met lage allelische ratio (< 0.5) , bi-allelisch gemuteerd CEBPA |
| Intermediair | gemuteerd NPM1 met FLT3-ITD met hoge allelische ratio (≥ 0.5) wild-type NPM1 zonder FLT3-ITD of met FLT3-ITD met lage allelische ratio (< 0.5) (en zonder andere ongunstige genetische eigenschappen) t(9;11)(p21.3;q23.3); MLLT3-KMT2A cytogenetische afwijkingen niet geclassificeerd als gunstig of ongunstig |
| Ongunstig | t(6;9)(p23;q34.1); DEK-NUP214 t(v;11q23.3); KMT2A bevattende translocaties t(9;22)(q34.1;q11.2); BCR-ABL1 inv(3)(q21.3q26.2) of t(3;3)(q21.3;q26.2); GATA2, MECOM(EVI1) -5 of del(5q) -7 -17/abn (17p) complex karyotype (≥ 3 chromosomale afwijkingen)*, monosomaal karyotype**, wild-type NPM1 en FLT3-ITD met hoge allellische ratio*** (≥ 0.5), gemuteerd RUNX1 (behalve in combinatie met gunstige merkers) gemuteerd ASXL1 (behalve in combinatie met gunstige merkers) gemuteerd TP53 |
* Complex karyotype: drie of meer niet gerelateerde chromosomale afwijkingen in de afwezigheid van 1 van de genetische afwijkingen volgens WHO gedefinieerd als “AML with recurrent genetic abnormalities”: i.e. (t(8;21), inv(16) or t(16;16), t(9;11), t(v;11)(v;q23.3), t(6;9), inv(3) or t(3;3); AML with BCR-ABL1)
** Monosomaal karyotype: aanwezigheid van een enkele monosomie (met uitzondering van X of Y) in combinatie met minimaal een additionele monosomie of structurele chromosomale afwijking.
*** FLT3 allelische ratio: semi kwantitatieve bepaling van de FLT3-ITD allel ratio (gebruik makend van DNA-fragment analyse) is bepaald als ratio van de “area under de curve” (AUC) FLT3-ITD gedeeld door de AUC FLT3-wild type.
Toevoegingen aan de risicoclassificatie van het ELN
Prognostische factoren, die in de ELN-classificatie niet worden genoemd:
– combinatie t(8;21) en KIT mutatie -> slechtere prognose dan enkel t(8;21) -> beschouwen als intermediair risico.
– NPM1 mutatie met additionele mutaties in FLT3 en DNMT3A of WT1 -> slechtere prognose (dit effect wordt mogelijk opgeheven bij MRD negativiteit na 2 intensieve kuren, echter bij oudere AML behandeld met intensieve chemotherapie, lijkt een negatieve MRD op NPM1 bij een combinatie NPM1 en DNMT3a niet voorspellend is en bestaat een hoge recidiefkans ondanks MRD negativiteit).
– hyperleukocytose bij diagnose (leukocyten ≥ 100) en geen CRe -> slechtere EFS en OS (mn in intermediaire risicogroep).
Prognose
Patiënten tot en met 60 jaar
| ELN2017 | Kans op CR | 5-jaars overleving |
| Gunstig | > 80% | 60-70% |
| Intermediair | 60-70% | 35-45% |
| Ongunstig | 40-50% | 20% |
Patiënten ouder dan 60 jaar
| ELN2017 | Kans op CR | 5-jaars overleving |
| Gunstig | 60-70% | 30-40% |
| Intermediair | 50-60% | 10-20% |
| Ongunstig | 30-40% | < 10% |
1e Lijns-behandeling
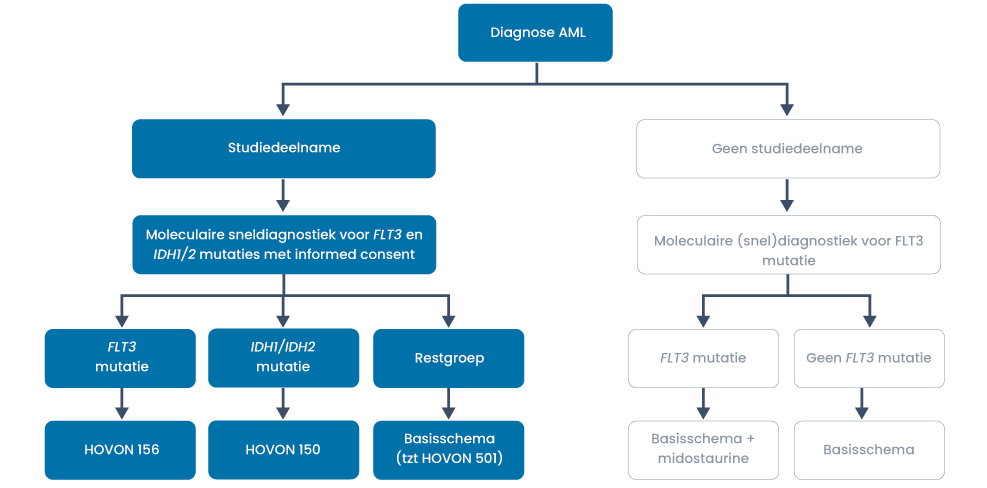
Filter trials en protocollen voor dit ziektebeeld1e lijns-behandeling voor patiënten met een standaard AML die fit zijn voor intensieve therapie
Basisschema
Cyclus 1
| Middel | Dosering | Dagen |
| Cytarabine | 200 mg/m2 continu | Dag 1 t/m 7 |
| Daunorubicine | 60 mg/m2 | Dag 1 t/m 3 |
Cyclus 2
| Middel | Dosering | Dagen |
| Cytarabine | 2 dd 1000 mg/m2 | Dag 1 t/m 6 |
| Daunorubicine * | 60 mg/m2 | Dag 1 t/m 3 |
* Patiënten > 61 jaar krijgen geen daunorubicine
Indien na een eerste inductiekuur geen: CR/ CRi/ MLFS dan ip. zo snel mogelijk doorstarten met tweede inductiekuur of behandeling met een HMA in combinatie met venetoclax (te bespreken in MDO).
De consolidatiebehandeling is afhankelijk van het risicoprofiel van de patiënt (zie paragraaf 6).
Bijzonderheden en uitzonderingen:
Patiënten > 61 jaar
- Indien fit voor intensieve therapie EN
- FLT3– of een IDH mutatie bij voorkeur behandeling in studieverband
- ELN goed risico behandeling met intensief schema
- Bij overige patiënten kan een HMA in combinatie met venetoclax de voorkeur hebben en dient overleg met een hematoloog uit de myeloide zuil overlegd te worden
AML met TP53 mutatie: Decitabine gevolgd door allogene HCT (er is geen meerwaarde van venetoclax aangetoond voor deze subgroep).
AML met FLT3-mutatie: Basisschema plus midostaurine 2 dd 50 mg, dag 8-21.
- na allogene HCT geen onderhoud
- na autologe HCT wel onderhoud gedurende 2 jaar (2 dd 50 mg)
Onderhouds-/ overbruggingsbehandeling bij remissie na intensieve inductiebehandeling (bijvoorbeeld voor (uitgestelde) allogene HCT of indien consolidatie niet mogelijk is): azacitidine 50 mg/m2 sc gedurende 5 dagen per 4 weken
1e lijns-behandeling voor patiënten met een standaard AML die niet fit zijn voor intensieve therapie
Fitheid wordt gescoord obv de HCT-CI score (of alternatief mbv de Ferrara criteria). Uiteraard speelt de voorkeur van de patiënt ook een belangrijke rol in de keuze van de behandelstrategie.
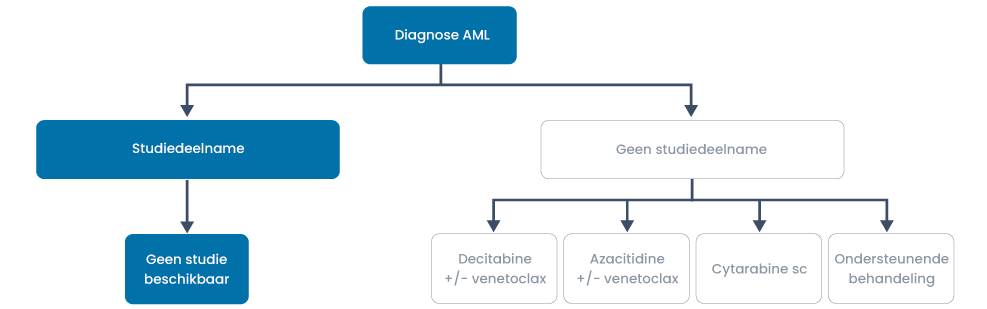
Voorkeursstrategie UMCG
- Voor start behandeling met HMA (en venetoclax): leukocyten reductie (tot WBC < 109/L) met hydrea (3 dd 2 g) ter voorkoming van tumorlyse en betere werking van HMA
Bij patiënten die mogelijk in 2e instantie in aanmerking zouden kunnen komen voor een allogene HSCT:
- 1e cyclus: decitabine (10 dagen) met venetoclax (met ramp-up schema)
- vervolcycli: azacitidine (7 dagen) met venetoclax
- Aandachtspunten hierbij zijn:
- de eerste kuur is klinisch tot aan dag 10, nadien indien ongecompliceerd beloop poliklinisch met 2 keer per week poliklinische controle van het bloedbeeld tot aan repopulatie, vervolgcycli kunnen poliklinisch gegeven worden
- voor exacte kuurschemata met dosering zie onderstaande tabellen, let vooral op de dosering van venetoclax ivm mogelijke interacties van CYP3A remmers
- bij kuur 1 wordt op dag 3 gestart met posaconazol tot aan de 2e cyclus. Vergeet niet de dosering venetoclax hiervoor aan te passen conform onderstaande tabel (bij starten en staken)
- beenmergonderzoek vindt plaats conform onderstaande tabel (hoe dan ook op dag 14 en voor cyclus 2)
Bij patiënten die van meet af aan nooit in aanmerking zullen komen voor een allogene HSCT:
- vanaf 1e cyclus azacitidine (7 dagen) met venetoclax
- Aandachtspunten hierbij zijn:
- de eerste kuur is klinisch tot aan dag 7, nadien indien ongecompliceerd beloop poliklinisch met 2 keer per week poliklinische controle van het bloedbeeld tot aan repopulatie, vervolgcycli kunnen poliklinisch gegeven worden
- voor exacte kuurschemata met dosering zie onderstaande tabellen, let vooral op de dosering van venetoclax ivm mogelijke interacties van CYP3A remmers
- bij kuur 1 wordt op dag 3 gestart met posaconazol tot aan de 2e cyclus. Vergeet niet de dosering venetoclax hiervoor aan te passen conform onderstaande tabel (bij starten en staken).
- beenmergonderzoek vindt plaats conform onderstaande tabel (hoe dan ook op dag 14 en voor cyclus 2)
AML met TP53 mutatie:
- HMA zonder venetoclax (er is geen meerwaarde van venetoclax aangetoond voor deze subgroep).
De dosering venetoclax:
De dosering moet worden aangepast bij eventuele combinatie met CYP3A remmers en myelotoxiciteit.
Doseringsadvies ten aanzien van venetoclax in combinatie met CYP3A remmers
| Reguliere dosering venetoclax*** | Geadviseerde dosering bij combinatie met matige CYP3A remmer* | Geadviseerde dosering bij combinatie met sterke CYP3A remmer** |
| 100 mg | 50 mg | 10 mg |
| 200 mg | 100 mg | 20 mg |
| 400 mg | 200 mg | 50 mg |
NB: na het staken van de CYP3A remmer, kan de dosering venetoclax (zonder opbouwschema) na 2-3 dagen in de reguliere dosering worden hervat
* Bijvoorbeeld: ciproxin, erytromycine, fluconazol isavuconazol, aprepitant, cimetidine, ciclosporine, verapamil NB: hetzelfde geldt voor P-gp remmers zo als amiodarone, carvedilol, quinidine
** Bijvoorbeeld: claritromycine, posaconazol, voriconazol, itraconazol, ketoconazol, diltiazem, lopinavir, ritonavir
*** venetoclax met voedsel innemen
Dosering venetoclax per cyclus
Cyclus 1
| Middel | Dosering | Dagen |
| Azacitidine | 75 mg/m2 sc | Dag 1 t/m 7 |
| of | ||
| Decitabine | 20 mg/m2 iv | Dag 1 t/m 10 |
| Venetoclax | Ramp-up
100 mg * po |
Dag 1 |
* Dosisreductie zie bovenstaande tabel “Doseringsadvies ten aanzien van venetoclax in combinatie met CYP3A remmers”
** Indien bij het beenmergonderzoek op dag 14 het aantal blasten < 5% is, wordt venetoclax gestaakt, bij > 5% blasten wordt gecontinueerd en het beenmergonderzoek een week later herhaald, bij < 5% wordt venetoclax gestaakt, bij > 5% blasten gecontinueerd tot maximaal 28 dagen.
Cyclus 2
Start cyclus pas indien neutrofielen > 0,5×109/L (maximaal 14 dagen uitstel)
| Middel | Responsstatus BM dag 28 voorgaande cyclus | Dosering | Dagen |
| Azacitidine | 75 mg/m2 sc | Dag 1 t/m 7** | |
| of | |||
| Decitabine | 20 mg/m2 iv | Dag 1 t/m 5** | |
| Venetoclax | < 5% blasten | 400 mg* | Dag 1 t/m 14*** |
| ≥ 5% blasten | 400 mg* | Dag 1-14, 21 of 28** | |
* Dosisreductie zie bovenstaande tabel “Doseringsadvies ten aanzien van venetoclax in combinatie met CYP3A remmers”
** conform cyclus 1
Cyclus 3 en verder
Start cyclus pas indien neutrofielen > 0,5×109/L (maximaal 14 dagen uitstel)
| Middel | Responsstatus | Dosering | Dagen |
| Azacitidine | 75 mg/m2 sc | Dag 1 t/m 7** | |
| of | |||
| Decitabine | 20 mg/m2 iv | Dag 1 t/m 5** | |
| Venetoclax | Bij voldoende hersteld bloedbeeld is een BM niet nodig, bij verdenking op onvoldoende respons of progressieve ziekte wel BM herhalen. | 400 mg* | Dag 1 t/m 14*** |
* Dosisreductie zie bovenstaande tabel “Doseringsadvies ten aanzien van venetoclax in combinatie met CYP3A remmers”
** Bij persisterende cytopenie (onder venetoclax 14 dagen) overweeg dosisreductie HMA (bv azacitidine 100 mg voor 5 of 7 dagen en/ of interval verlenging)
*** Overweeg venetoclax te staken als er na 2 kuren geen blasten controle is ontstaan.
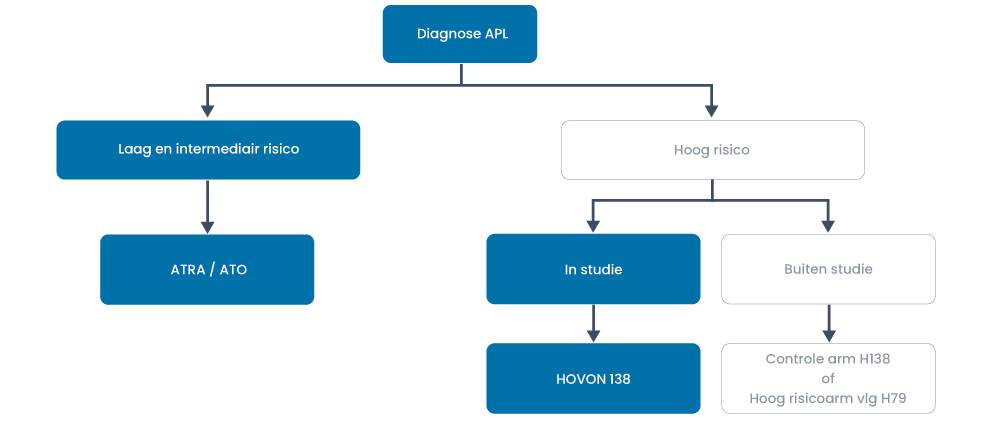
Acute Promyelocyten Leukemie (APL)
Risico groepen volgens Sanz score:
- Laag risico: WBC ≤ 10×109/L en trombocyten > 40×109/L
- Intermediair risico: WBC ≤ 10×109/L en trombocyten ≤ 40×109/L
- Hoog risico: WBC > 10×109/L
Bij de geringste verdenking op een APL start direct met ATRA (45 mg/m2 per dag verdeeld over 2 giften).
Speciale aandacht voor:
- Het APL-differentiatiesyndroom (A-DS); Start ter preventie met prednisolon 0,5 mg/kg/dag (dag 1-21); zie ook paragraaf 9.3;
- Stollingsafwijkingen (symptomatische trombose 5%, (fatale) bloedingen 5-10%);
- Géén profylactische antistolling of tranexaminezuur
- Streefwaarden eerste 10 dagen Hb > 5,5 mmol/L en T > 30×109/L (NB: bij hoog risico op bloeding (i.e. > 70 jaar; leucocyten > 10×109/L; kreat > 140 umol/L) dan T > 50×109/L);
- Correctie van fibrinogeen middels FFP’s of cyroprecipitaat (doel boven de 1-1.5 g/L)
- Geen centraal veneuze lijn plaatsen en of aferese;
- Pseudotumor cerebri = verhoogde intracerebrale liquordruk door ATRA (behandeling: tijdelijk staken ATRA, start dexamethason 2 dd 5 mg)
Belangrijkste bijwerkingen van ATO:
- QT-tijd verlenging (min. Wekelijks ECG)
Onderbreek ATO en andere medicatie met invloed op QTc-tijd bij > 450 ms voor mannen en > 460 voor vrouwen (hervatten bij normalisatie van de QTc-tijd met een dosering van 50% (0.075mg/kg), evt wekelijks geleidelijk ophogen naar 0.11 mg/kg) - Hepatotoxiciteit.
Onderbreek ATO en/ of ATRA bij bilirubine en/of ASAT en/of AF > 5xULN (hervatten bij daling naar < 4 x ULN met dosering van 50% na een week evt ophogen naar100%)
Zeldzame vormen van AML
Genetische varianten van APL: standaard AML-inductietherapie
Blastair dendritische cel neoplasie (BPDCN): ALL of AML behandeling gevolgd door allogene HCT
Mixed Phenotype Acute Leukemia (MPAL): ALL-behandeling gevolgd door allogene HCT. Bij t(9;22) TKI toevogen.
Consolidatie inclusief hematopoëtische celtransplantatie
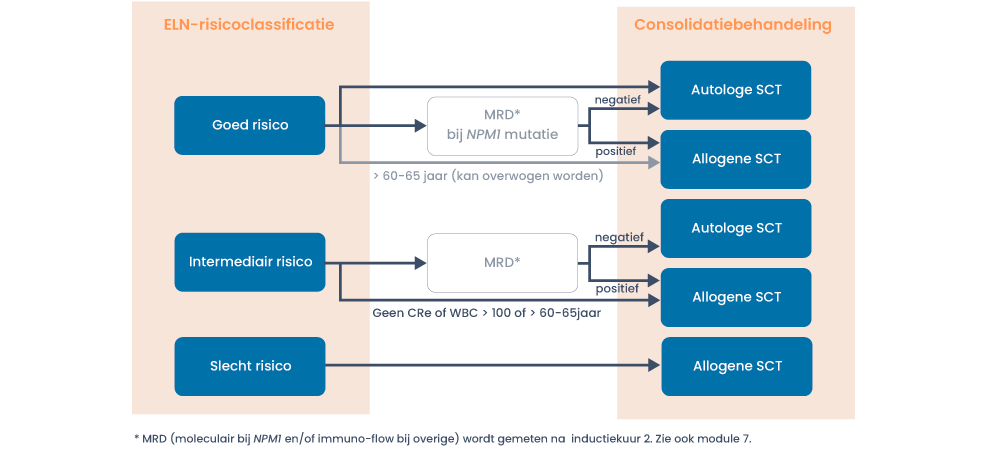
Met de geïntegreerde EBMT HCT-CI score kan de toxiciteit/ non-relapse mortaliteit (NRM) van een reduced intensity allogene SCT ingeschat worden.
Indien van toepassing vindt stamcelaferese ip plaats na de tweede inductiekuur. Stamcelmobilisatie geschiedt met G-CSF (sc, 10 µg/kg verdeeld over twee giften per dag).
Indien een geplande autologe hematopoiëtische stamcel transplantatie niet gerealiseerd kan worden (bijvoorbeeld als de stamcelaferese niet lukt) kan een consolidatiekuur overwogen worden.
Voor conditioneringsschema voor een allogene hematopoëtische stamceltransplantatie bij een patiënt met AML.
Behandeling van refractaire ziekte of recidief
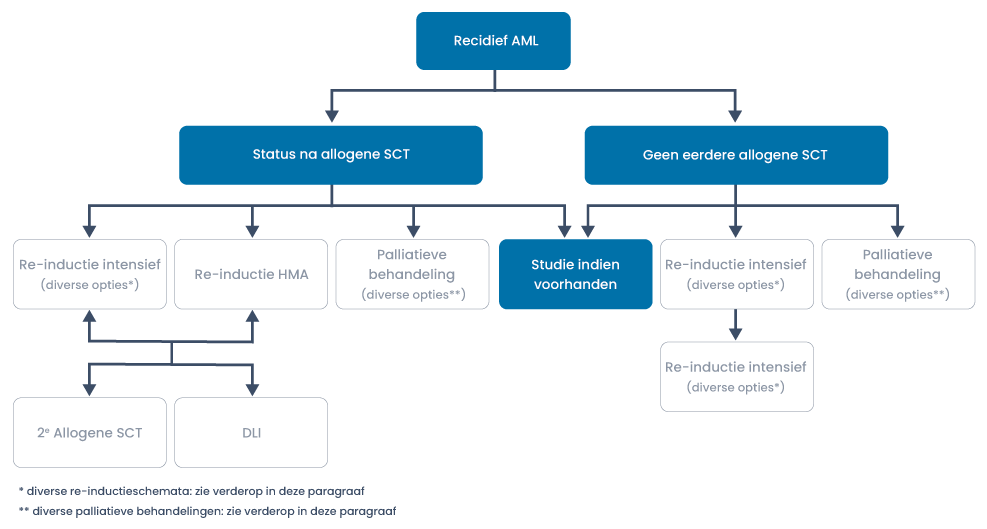
Prognose bij recidief AML
Formule ter berekening van het risico:
0,016*(leeftijd in jaren) – 0,068*(recidiefvrij interval in maanden) – 0,50*[t(8;21), nee=0, ja=1] – 1,24*[t(16;16) of inv(16), nee=0, ja=1]+0,43*(eerdere SCT, nee=0, ja=1)
| Risico | Score | 1-jaarsoverleving | 5-jaars-overleving |
| Laag | 1 t/m 6 | 70% | 46% |
| Intermediair | 7 t/m 9 | 49% | 18% |
| Hoog | 10 t/m 14 | 16% | 4% |
Mogelijke strategieën voor re-inductie:
- Intensieve chemotherapie
- Gebaseerd op hypomethylerende middelen
- Experimentele behandeling (fase 1/2 studies)
- Therapie gericht op een specifieke moleculaire afwijking
Recidief APL
Re-inductietherapie middels ATO en ATRA afhankelijk van de respons gevolgd autologe of allogene HCT.
Responsbeoordeling
Responsbeoordeling volgens ELN-criteria (2017)
| Respons | Definitie |
| CRMRD- | CR, MRD negatief (RT-qPCR en/of flowcytometrie) |
| CR | < 5% BM blasten Geen circulerende blasten, geen Auerse staven, geen extramedullaire ziekte Neutrofielen ≥ 1.0×109/L en trombocyten ≥ 100×109/L |
| CRi | Voldoet aan CR-criteria, behalve: Neutrofielen < 1.0×109/L of trombocyten < 100×109/L |
| Morphologisch leukemie-vrije situatie (MLFS) | < 5% BM blasten Geen circulerende blasten, geen Auerse staven, geen extramedullaire ziekte Geen herstel van het bloedbeeld/ beenmergcellulariteit (NB: er moeten wel 200 cellen geteld zijn of de cellulariteit moet tenminste 10% zijn) Dus: Neutrofielen < 1.0×109/L en trombocyten < 100×109/L |
| PR | 5-25 % blasten in het beenmerg en tenminste 50% afname van het aantal blasten in het beenmerg Neutrofielen ≥ 1.0×109/L en trombocyten ≥ 100×109/L |
Klinisch belangrijkste methoden voor MRD-metingen:
- Multiparameter flowcytometrie (MFC)
- “real-time” kwantitatieve PCR
Bijzondere omstandigheden ten aanzien van behandeling
Behandeling bij hyperleukocytose en leukostase
Definitie: aantal leukocyten > 100×109/L
Klinische manifestaties:
- Leukostase (25-50%)
- Diffuse intravasale stolling (DIS) (30-40%)
- Tumorlysissyndroom (10%)
Belangrijk onderzoek: Fundoscopie (ter bepaling van papiloedeem, gedilateerde vaten en retinabloedingen).
Behandeling:
- behandeling van leukostase, DIC en tumorlyse.
- directe behandeling met intensieve chemotherapie of hydroxycarbamide
Aandachtspunten en of behandelmogelijkheden:
- Erytrocytentransfusies waar mogelijk uitstellen (anders à 4 uur toedienen).
- Trombocytentransfusie indien < 20-30×109/L.
- Lumbaalpunctie na verdwijnen van blasten uit het perifere bloed.
- Leukaferese kan (bij symptomen van leukostase) overwogen worden als er geen contra-indicaties (zoals bijvoorbeeld APL, stollingsstoornissen inclusief DIC, cardiovasculaire co-morbiditeit) zijn. Echter is niet aangetoond dat hierdoor de (“vroege”) sterfte wordt verminderd.
- Hoge dosis corticosteroïden (dexamethason 2 dd 10 mg voor 3 dagen)
Diagnostiek en behandeling (verdenking) centraal zenuwstelsel (CZS)-lokalisatie
1e lumbaalpunctie NA het klaren van blasten in het perifere bloed:
- Diagnostiek naar liquorbetrokkenheid (cytomorfologie en flowcytometrie)
- cytarabine i.t.
Bij liquorbetrokkenheid naast systemische behandeling intrathecale behandelingen:
- Cytarabine 100 mg (bij refractair beeld of toxiciteit MTX 15 mg)
- Prednisolon 20 mg
Het schema hiervoor is als volgt:
- 2 keer per week totdat de liquor “schoon” is, vervolgens
- 4 keer wekelijks
- 2 keer om de week
- 4 keer maandelijks
Differentiatiesyndromen
Differentiatiesyndroom bij APL (A-DS)
Denk aan het A-DS bij onderstaande symptomen (2-3 = matig, > 4 = ernstig):
- (Onverklaarde) koorts
- Kortademigheid
- Pleura en/of pericardvocht
- Longinfiltraten
- Nierfalen
- Hypotensie
- Onverklaarde gewichtstoename (>5 kg)
Behandeling
- Ter voorkoming:
- Leukocyten >5×109/L: dexamethason 2 dd 5 mg; dag 1-15
- Leukocytose > 10×109/L tevens hydroxycarbamide toevoegen
- Bij (verdenking) A-DS:
- Dexamethason 2 dd 10 mg
- In principe ATRA en/of ATO continueren, tenzij ICU opname noodzakelijk of reeds > 2 weken ATRA en/of ATO
- Bij herstel van klachten:
- Steroïden staken/ afbouwen
- ATRA/ATO indien aan de orde hervatten (start met 50% in een week opbouwen tot 100%).
FLT3-remmer geïnduceerd differentiatiesyndroom
Denk aan het FLT3-DS bij onderstaande symptomen:
- Febris eci
- Respiratoire problemen (dyspnoe, pleuravocht, longoedeem)
- Pericardvocht
- Hypotensie
- Vochtretentie (oedeem) met gewichtstoename
- Rash
- Nierfunctiestoornissen
- Febriele neutrofiele dermatose
Behandeling:
- Dexamethason i.v. 2 dd 10 mg tot afname klachten (minimaal 3 dagen, zo nodig afbouwen)
- FLT-3 remmer onderbreken bij ernstige symptomen > 48 uur na start steroïden. Hervatten (100%) indien symptomen < graad 2.
IDH-remmer geïnduceerd differentiatiesyndroom
Denk aan het IDH-DS bij onderstaande symptomen:
- Respiratoire problemen (interstitiële pulmonale infiltraten, pleuravocht, hypoxemie)
- Pericardvocht
- Vochtretentie (oedeem) met gewichtstoename
- Febris eci
- Rash
- Nier- en leverfunctiestoornissen
- Lymfadenopathie
- Botpijn
- Evt neutrofielie, trombocytose, stollingsstoornissen en uitrijping in beenmerg
Behandeling:
- Dexamethason 2 dd 10 mg tot afname klachten (minimaal 3 dagen)
- Hydroxycarbamide (en zo nodig leukaferese) bij leukocytose
- Furosemide zo nodig te geven.
- IDH-remmer onderbreken bij ernstige pulmonale en/ of renale problemen > 48 uur na start steroïden
Tumorlyse
Neurotoxiciteit bij cytarabine
Denk aan het neurotoxiciteit bij cytarabine bij onderstaande symptomen:
- Na i.t.-toediening: myelopathie, insulten
- Na i.v. toediening: perifere neuropathie, gegeneraliseerde encefalopathie (somnolentie, verwardheid, geheugenverlies, psychose, insulten) en (acute) cerebellaire toxiciteit (vooral dag 3-8) met ataxie, nystagmus en dysarthrie
Behandeling:
- Cytarabine onmiddellijk staken
Behandeling van pneumonitis tgv cytarabine of HMA
Denk aan pneumonitis tgv cytarabine of HMA bij onderstaande symptomen:
- koorts
- hoesten
- kortademigheid
En het ontbreken van een alternatieve diagnose.
Behandeling:
- Cytarabine/ HMA direct staken
- Hoge dosis steroïden
Familiaire predispositie
Screening voor germline-predispositie (middels speeksel of BM in remissie) bij:
- Verdachte familieanamnese
- Specifieke bevindingen bij lichamelijk onderzoek (zie tabel)
- Mutaties van RUNX1, TP53 of CEBPA met een VAF > 40%
NB: Patiënt informeren over geplande screening en consequenties
Bevindingen, die op een germline-mutatie zouden kunnen wijzen
| Syndroom (mutatie) | Mogelijke manifestaties |
| Familiair MDS/AML met gemuteerd GATA2 (Emberger syndroom, MonoMac syndroom) (GATA2) | Congenitale doofheid, immunodeficiëntie (opportunistische infecties), pulmonale alveolaire proteïnose, cutane of anogenitale wratten, primair lymfoedeem |
| Familiaire trombocyten stoornis met neiging tot myeloide maligniteit (RUNX1) | Trombocytopenie |
| Trombocytopenie 2 (ANKRD2) en trombocytopenie 5 (ETV6) | Trombocytopenie |
| Li-Fraumeni syndroom (TP53) | Cerebrale, adrenale en mamma-maligniteiten, sarcoom |
| Teleomeer problemen (TERT/ TERC) | Vroegtijdig grijs worden, afwijkende reticulaire huidpigmentatie, nageldystrofie, vroege hoofd-/ hals of anogenitale maligniteiten, huidmaligniteiten, orale leukoplakie, longfibrose/ emfyseem, idiopatische levercirrose |
| Fanconi anemie (FANCA, FANCB, etc.) | Klein, dysmorf gelaat, café au lait vlekken, duimafwijkingen, skeletafwijkingen |
| Diamond-Blackfan anemie (verschillende RPL en RPS genen) | Duimafwijkingen, klein, dysmorf gelaat |
| Shwachman-Diamond syndrome (SBDS)
|
Steathorrhoe, klein, thoraxdysplasie |
| Ernstige congenitale neutropenie (ELANE, HAX1) | Neutropenie |
| Familair MDS/AML met gemuteerd DDX41 (DDX41) | Cytopenie |
Ondersteunende handelingen
- Afnemen van surveillancekweken en gebruik van antibiotische profylaxe
- Transfusies, NB: rondom stamcelaferese en -transplantatie dienen bestraalde bloedproducten gegeven te worden.
- Extra maatregelen ter voorkoming van infecties:
- Multi-disciplinair opgestelde protocollen tav infectiepreventie, -detectie en -behandeling
- Geen bloemen op kamer/afdeling
- Kiemarme voeding tijdens aplasie
- Bij (langdurige) neutropenie verpleging op isolatiekamer waar mogelijk (volgorde van voorrang: allogene SCT na myeloablatieve conditionering, primaire behandeling acute leukemie (AML > ALL), ATG-behandeling, autologe SCT, recidief acute leukemie); behandeling op een isolatiekamer is echter niet obligaat.
- Bij vrouwen met IUD (spiraal) deze verwijderen
- Geen suppositoria, niet rectaal temperaturen
- Vrouwen in fertiele leeftijd: norethisteron 1 dd 5 – 10 mg ter menstruatieonderdrukking
- Anti-emetica: ondansetron; zo nodig aanvullen met metoclopramide, lorazepam; dexamethason en/ of aprepitant
- Bij hoge dosis cytarabine (≥ 1000 mg/12 uur): hypromellose oogdruppels, zo nodig aangevuld met dexamethason oogdruppels (1 mg/ ml 4 dd 1 druppel)
- Goede centraal veneuze toegang (CVL of PICC-lijn) bij intensieve kuren (let op adequate stolling, complicaties zo al pneumothorax en ritmestoornissen)
- Goede intake-controle door diëtetiek met bijvoeding waar nodig.
- Diarree-remmers (loperamide) bij ernstige, niet-infectieuze diarree
- Goede bewegingsondersteuning door fysiotherapie
- Psychosociale begeleiding
(Therapie)schemata
Basisschema
Cyclus 1
| Middel | Dosering | Dagen |
| Cytarabine | 200 mg/m2 continu | Dag 1 t/m 7 |
| Daunorubicine | 60 mg/m2 | Dag 1 t/m 3 |
Cyclus 2
| Middel | Dosering | Dagen |
| Cytarabine | 2 dd 1000 mg/m2 | Dag 1 t/m 6 |
| Daunorubicine * | 60 mg/m2 | Dag 1 t/m 3 |
* Patiënten > 61 jaar krijgen geen daunorubicine
Onderhoudsbehandeling na intensieve therapie
| Middel | Dosering | Dagen |
| Azacitidine | 50 mg/m2 * | Dag 1 t/m 5 |
* wordt gegeven a 4 weken
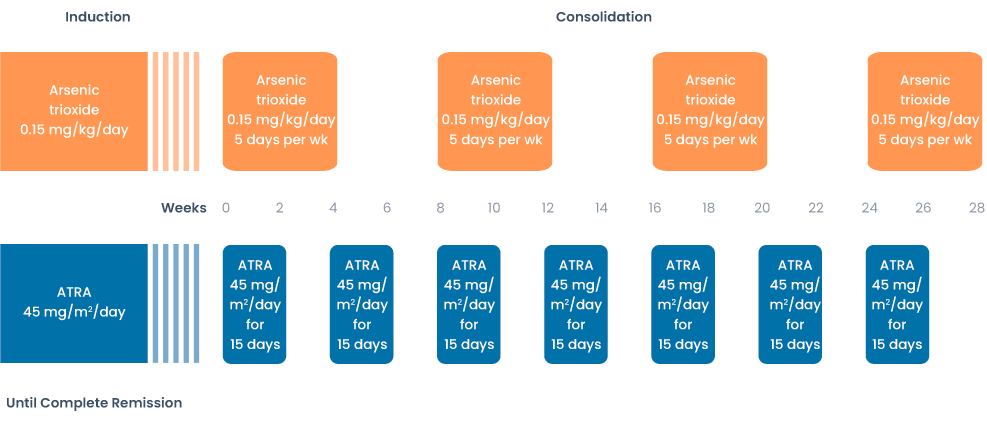
APL laag en intermediair risico
Inductie
| Middel | Dosering | Dagen |
| ATO (arseentrioxide) | 0,15 mg/kg | Dag 1 t/m 28 of telkens met een week verlengt tot aan CR |
| ATRA (all-transretinoïnezuur) | 45 mg/m2 verdeeld over 2 giften per dag | Dag 1 t/m 28 of telkens met een week verlengt tot aan CR |
Consolidatie
| Middel | Dosering | Dagen |
| ATO (arseentrioxide) | 0,15 mg/kg | Dag 1 t/m 5 Gedurende 4 weken Gevolgd door 4 weken rust |
| ATRA (all-transretinoïnezuur) | 45 mg/m2 verdeeld over 2 giften per dag | Dag 1 t/m 14 Gedurende 2 weken Gevolgd door 2 weken rust |
De consolidatiebehandeling wordt minimaal 4 keer herhaald of tot aan CR (laatste cyclus 1 blok ATRA ipv 2)
APL hoog risico
Inductie
| Middel | Dosering | Dagen |
| Idarubicine | 0,12 mg/m2 | Dag 2, 4 , 6 en 8 * |
| ATRA (all-transretinoïnezuur) | 45 mg/m2 verdeeld over 2 giften per dag | Dag 1 t/m 28 of telkens met een week verlengt tot aan CR |
* patiënten > 70 jaar: dag 8 laten vervallen
Consolidatie cyclus 1
| Middel | Dosering | Dagen |
| Idarubicine | 5 mg/m2 | Dag 1 t/m 4 |
| Cytarabine | 1000 mg/m2 | Dag 1 t/m 4 |
| ATRA (all-transretinoïnezuur) | 45 mg/m2 verdeeld over 2 giften per dag | Dag 1 t/m 15 |
Consolidatie cyclus 2
| Middel | Dosering | Dagen |
| Mitoxantrone | 10 mg/m2 | Dag 1 t/m 5 |
| ATRA (all-transretinoïnezuur) | 45 mg/m2 verdeeld over 2 giften per dag | Dag 1 t/m 15 |
Consolidatie cyclus 3
| Middel | Dosering | Dagen |
| Idarubicine | 12 mg/m2 | Dag 1 |
| Cytarabine | 3 dd 150 mg/m2 sc | Dag 1 t/m 4 |
| ATRA (all-transretinoïnezuur) | 45 mg/m2 verdeeld over 2 giften per dag | Dag 1 t/m 15 |
Onderhoudsbehandeling (2 jaar), indien in CR
| Middel | Dosering | Dagen |
| 6-Mercaptopurine | 1 dd 50 mg/m2 ** | Dag 1 t/m 28 * |
| MTX | 15 mg/m2 ** | Dag 1 * |
| ATRA (all-transretinoïnezuur) | 45 mg/m2 verdeeld over 2 giften per dag | Elke 3 maanden Dag 1 t/m 15 |
* alle 3 maanden voor 15 dagen onderbreken tijdens ATRA
** dosisreducties neutropenie 1-1.5×109/L dosis halveren, neutropenie < 0,5×109/L stop onderhoud tijdelijk, zo nodig dosisreductie MTX bij lever- / nierfunctiestoornissen conform farmacotherapeutisch kompas
Decitabine
Inductie (tot blasten in beenmerg < 5%)
| Middel | Dosering | Dagen |
| Decitabine | 20 mg/m2 | Dag 1 t/m 10 |
Elke 4 weken
Onderhoud (tot aan progressie)
| Middel | Dosering | Dagen |
| Decitabine | 20 mg/m2 | Dag 1 t/m 5 |
Elke 4 weken
Azacitidine
| Middel | Dosering | Dagen |
| Azacitidine | 75 mg/m2 * | Dag 1 t/m 7 of Dag 1 t/m 5 en 8 t/m 9 * |
Elke 4 weken
* Bij cytopenie (zonder aanwijzingen voor progressieve ziekte) eventueel dosis reduceren naar 100 mg (fixed dose) voor 7 dagen en/ of naar 5 dagen.
HMA + venetoclax
De dosering venetoclax:
De dosering moet worden aangepast bij eventuele combinatie met CYP3A remmers en myelotoxiciteit.
Doseringsadvies ten aanzien van venetoclax in combinatie met CYP3A remmers
| Reguliere dosering venetoclax*** | Geadviseerde dosering bij combinatie met matige CYP3A remmer* | Geadviseerde dosering bij combinatie met sterke CYP3A remmer** |
| 100 mg | 50 mg | 10 mg |
| 200 mg | 100 mg | 20 mg |
| 400 mg | 200 mg | 100 mg |
NB: na het staken van de CYP3A remmer, kan de dosering venetoclax (zonder opbouwschema) na 2-3 dagen in de reguliere dosering worden hervat
* Bijvoorbeeld: ciproxin, erytromycine, fluconazol isavuconazol, aprepitant, cimetidine, ciclosporine, verapamil NB: hetzelfde geldt voor P-gp remmers zo als amiodarone, carvedilol, quinidine
** Bijvoorbeeld: claritromycine, posaconazol, voriconazol, itraconazol, ketoconazol, diltiazem, lopinavir, ritonavir
*** venetoclax met voedsel innemen
Dosering HMA + venetoclax per cyclus
Cyclus 1
| Middel | Dosering | Dagen |
| Azacitidine | 75 mg/m2 sc | Dag 1 t/m 7 |
| of | ||
| Decitabine | 20 mg/ m2 iv | Dag 1 t/m 10 |
| Venetoclax | Ramp-up 100 mg* po 200 mg * po 400 mg*po |
Dag 1 |
* Dosisreductie zie bovenstaande tabel “Doseringsadvies ten aanzien van venetoclax in combinatie met CYP3A remmers”
** Indien bij het beenmergonderzoek op dag 14 het aantal blasten < 5% is, wordt venetoclax gestaakt, bij > 5% blasten wordt gecontinueerd en het beenmergonderzoek een week later herhaald, bij < 5% wordt venetoclax gestaakt, bij > 5% blasten gecontinueerd tot maximaal 28 dagen.
Cyclus 2
Start cyclus pas indien neutrofielen > 0,5×109/L (maximaal 14 dagen uitstel)
| Middel | Responsstatus BM dag 28 voorgaande cyclus | Dosering | Dagen |
| Azacitidine | 75 mg/m2 sc | Dag 1 t/m 7 | |
| of | |||
| Decitabine | 20 mg/ m2 iv | Dag 1 t/m 5 | |
| Venetoclax | <5% blasten | 400 mg* | Dag 1 t/m 14 |
| >5% blasten | 400 mg* | Dag 1-14, 21 of 28** |
* Dosisreductie zie bovenstaande tabel “Doseringsadvies ten aanzien van venetoclax in combinatie met CYP3A remmers”
** conform cyclus 1
Cyclus 3 en verder
Start cyclus pas indien neutrofielen > 0,5×109/L (maximaal 14 dagen uitstel)
| Middel | Responsstatus | Dosering | Dagen |
| Azacitidine | 75 mg/m2 sc | Dag 1 t/m 7 ** | |
| of | |||
| Decitabine | 20 mg/ m2 iv | Dag 1 t/m 5 ** | |
| Venetoclax | Bij voldoende hersteld bloedbeeld is een BM niet nodig, bij verdenking op onvoldoende respons of progressieve ziekte wel BM herhalen. | 400 mg * | Dag 1 t/m 14 *** |
* Dosisreductie zie bovenstaande tabel “Doseringsadvies ten aanzien van venetoclax in combinatie met CYP3A remmers”
** Bij persisterende cytopenie (onder venetoclax 14 dagen) overweeg dosisreductie HMA (bv azacitidine 100 mg voor 5 of 7 dagen en/ of interval verlenging)
*** Overweeg venetoclax te staken als er na 2 kuren geen blasten controle is ontstaan.
Cytarabine (lage dosering sc)
| Middel | Dosering | Dagen |
| Cytarabine | 2 dd 20 mg sc | Dag 1 t/m 10 |
Elke 4-6 weken
Consolidatie intensieve therapie
Cyclus 3
| Middel | Dosering | Dagen |
| Mitoxantrone | 10 mg/m2 | Dag 1 t/m 5 * |
| Etoposide | 100 mg/m2 | Dag 1 t/m 5 * |
* Patiënten > 61 jaar krijgen een dosisaanpassing mitoxantrone en etoposide dag 1 t/m 3
Conditionering autologe transplantatie
| Middel | Dosering | Dagen |
| Busulfan oraal | 4 dd 1 mg/kg | Dag -7 t/m -4 |
| of | ||
| Busulfan i.v. | 4 dd 0.8 mg/kg/AIBW of 1 dd 3,2 mg/kg | |
| Cyclofosfamide | 60 mg/kg | Dag -3 t/m -2 |
| Fenytoine | 4 dd 5 mg/kg 1 dd 5 mg/kg |
Dag -9 Dag -8 t/m -4 |
| of | ||
| Diazepam | 4 dd 5 mg p.o. | Dag -8 t/m -3 |
| Uromitexan (Mesna) | 12 mg/kg in een kwartier gevolgd door 60 mg/kg in 24 uur |
Dag -3 t/m -2 |
| Stamcelteruggave | Dag 0 |
Refractaire AML of recidiefbehandeling
FLAMSA-RIC
| Middel | Dosering | Dagen |
| Fludarabine | 4 dd 30 mg/m2 | Dag -12 t/m -9 |
| Cytarabine | 4 dd 2 g/m2 | Dag -12 t/m -9 |
| Amsacrine | 4 dd 100 mg/m2 | Dag -12 t/m -9 |
| TBI | 4 Gy | Dag -5 |
| Cyclofosfamide | 40 mg/kg bij SIB 60 mg/kg bij MUD |
Dag -4 t/m -3 |
| ATG | 10 mg/kg bij SIB 20 mg/kg bij MUD |
Dag -4 t/m -2 |
| Stamcelinfusie | Dag 0 |
IDAC
| Middel | Dosering | Dagen |
| Cytarabine | 2 dd 1000-1500 mg/m2 | Dag 1 t/m 6 * |
| Daunorubicine | 45-60 mg/m2 | Dag 1 t/m 3 * |
| of | ||
| Idarubicine | 8-10 mg/m2 | Dag 3 t/m 5 |
| of | ||
| Mitoxantrone | 8-10 mg/m2 | Dag 1 t/m 3 |
* Patiënten > 61 jaar krijgen 3 dagen ipv 6 dagen
MEC
| Middel | Dosering | Dagen |
| Mitoxantrone | 8 mg/m2 | Dag 1 t/m 5 |
| Etoposide | 100 mg/m2 | Dag 1 t/m 3 |
| Cytarabine | 1000 mg/m2 | Dag 1 t/m 5 |
FLAG-IDA
| Middel | Dosering | Dagen |
| Fludarabine | 30 mg/m2 | Dag 2 t/m 6 |
| Cytarabine | 1500-2000 mg/m2 | Dag 2 t/m 6 |
| Idarubicine | 10 mg/m2 | Dag 2 t/m 4 |
| G-CSF | 5 µg/kg sc | Dag 1 t/m 5 |
HAM
| Middel | Dosering | Dagen |
| Cytarabine | 2 dd 3000 mg/m2 | Dag 1 t/m 5 |
| Mitoxantrone | 12 mg/m2 | Dag 3 t/m 5 |
Hoge dosis cytarabine
| Middel | Dosering | Dagen |
| Cytarabine | 2 dd 3000 mg/m2 | Dag 1 t/m 6 |
Literatuurlijst
- Richtlijn AML, HOVON – Acute leukemie-werkgroep, versie 29-06-2021
- Arber D.A., et al. The 2016 revision of the WHO classification of myeloid neoplasms and acute leukemia. 2016:127:2391-24
- Döhner H, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. 2017;129(4):424-44
- Döhner H, et al; European LeukemiaNet. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. 2010;115(3):453-474.
- Heuser M, et al. Acute myeloid leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020 Jun;31(6):697-712.
- Abdulrahman AA, et al. Is a 500-cell count necessary for bone marrow differentials?: a proposed analytical method for validating a lower cutoff. Am J Clin Pathol. 2018;150:84e91.
- Bene MC, et al. Immunophenotyping of acute leukemia and lymphoproliferative disorders: a consensus proposal of the European LeukemiaNet Work Package 10. Leukemia. 2011;25: 567e574.
- Cancer Genome Atlas Research Network. Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia. N Engl J Med. 2013;368(22):2059-2074.
- Papaemmanuil E, et al. Genomic classification and prognosis in acute myeloid leukemia. N Engl J Med. 2016;374(23): 2209-2221.
- https://richtlijnendatabase.nl/richtlijn/fertiliteitsbehoud bij vrouwen met kanker/tumorspecifieke interventies/hemato oncologie/acute myeloide
- Herold T, et al. Validation and refinement of the revised 2017 European Leukemia Net genetic risk stratification of acute myeloid leukemia. Leukemia. 2020. doi.org/10.1038/s41375-020-0806-0
- O’Donnell MR, et Acute Myeloid Leukemia, Version 3.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2017 Jul;15(7):926-957.
- Löwenberg B, et al. Cytarabine dose for acute myeloid leukemia. NEJM. 2011:364:1027-1036 [HOVON 42]
- Löwenberg B, et al. Addition of lenalidomide to intensive treatment in younger and middle-aged adults with newly diagnosed AML-the HOVON-SAKK-132 trial. Blood Adv. 2021 Feb 23;5(4):1110-1121 [HOVON 132]
- Ossenkoppele G, et al. Lenalidomide added to standard intensive treatment for older patients with AML and high-risk MDS. Leukemia. 2020:34(7):1751-1759 [HOVON 103]
- Patel JP, et al. Prognostic relevance of integrated genetic profiling in acute myeloid leukemia. N Engl J Med. 2012; 366(12):1079-1089
- Bhatt VR, et Early mortality and overall survival of acute myeloid leukemia based on facility type. Am J Hematol. 2017;92:764–771.
- Ostronoff F, et Prognostic significance of NPM1 mutations in the absence of FLT3-internal tandem duplication in older patients with acute myeloid leukemia: a SWOG and UK National Cancer Research Institute/Medical Research Council report. J Clin Oncol 2015;33:1157-64.
- Schlenk RF, et Mutations and treatment outcome in cytogenetically normal acute myeloid leukemia. N Engl J Med. 2008;358:1909-18.
- Büchner, T, et al. Age-related risk profile and chemotherapy dose response in acute myeloid leukemia: a study by the German Acute Myeloid Leukemia Cooperative Group. J Clin Oncol. 2009:27:61-69.
- Eisfeld et al. Additional gene mutations may refine the 2017 European LeukemiaNet classification in adult patients with de novo acute myeloid leukemia aged < 60 years. Leukemia 2020; 34;3215-3227
- Paschka P, et al. Adverse prognostic significance of KIT mutations in adult acute myeloid leukemia with inv(16) and t(8;21): a cancer and leukemia Group B study. JCO 2006; 24:3904-3911
- Heiblig M, et al. Impact of DNMT3A status on induction NPM1 MRD predictive value on survival in elderly AML patients treated intensively. ASH 2020: abstract 462.
- Döhner H, et al. Acute myeloid N Engl J Med. 2015:373:1136-1152.
- Rowe JM, Tallman How I treat acute myeloid leukemia. Blood. 2010 Oct 28;116(17):3147-56.
- DiNardo CD, Wei AH. How I treat acute myeloid leukemia in the era of new drugs. 2020 ; 135(2):85-96.
- Ofran Y, Tallman MS, Rowe JM. How I treat acute myeloid leukemia presenting with preexisting comorbidities. 2016 ; 128(4):488-496
- Bakst R, et How I treat extramedullary acute myeloid leukemia. Blood. 2011:118:3785-3793.
- Lancet JE, et al. CPX-351 (cytarabine and daunorubicin) liposome for injection versus conventional cytarabine plus daunorubicin in older patients with newly diagnosed secondary acute myeloid leukemia. J Clin Oncol. 2018;36(26):2684-2692.
- Ossenkoppele G, Löwenberg How I treat the older patient with acute myeloid leukemia. Blood. 2015 Jan 29;125(5):767-74.
- Klepin HD, Rao AV, Pardee Acute myeloid leukemia and myelodysplastic syndromes in older adults. J Clin Oncol 2014;32:2541-52.
- Kharfan-Dabaja MA, et Haematopoietic cell transplantation for blastic plasmacytoid dendritic cell neoplasm: a North American multicentre collaborative study. Br J Haematol 2017;179:781-789.
- Pemmaraju N, et al. Tagraxofusp in blastic plasmacytoid dendritic-cell neoplasm. N Engl J Med 2019;380:1628-1637.
- Stone RM, et Midostaurin plus chemotherapy for acute myeloid leukemia with a FLT3 mutation. N Engl J Med 2017:377:454-464.
- Hills RK, et al. The Addition of Gemtuzumab Ozogamicin to Induction Chemotherapy in Acute Myeloid Leukaemia : An IndividualPatient Data Meta-analysis of Randomised Trials in Adults. Lancet Oncol. 2014 Aug; 15(9): 986–996.
- Wolach O, Stone How I treat mixed-phenotype acute leukemia. Blood. 2015:125:2477- 2485
- Giles FJ et al. The haematopoietic cell transplantation comorbidity index score is predictive of early death and survival in patients over 60 years of age receiving induction therapy for acute myeloid leukaemia. Br J Haematol 2007;136:624-7.
- DiNardo CD, Wei AH. How I treat acute myeloid leukemia in the era of new drugs. Blood. 2020:135(2):85-96.
- Stein EM, et al. Ivosidenib or enasidenib combined with intensive chemotherapy in patients with newly diagnosed AML: a phase 1 study. Blood. 2021:137(13):1792-1803
- Welch JS et al. TP53 and decitabine in acute myeloid leukemia and myelodysplastic syndromes. NEJM. 2016:375:2023-2036.
- Huls Get al. Azacitidine maintenance after intensive chemotherapy improves DFS in older AML patients. Blood. 2019:133(13):1457-1464.
- Wei AH et al. Oral Azacitidine Maintenance Therapy for Acute Myeloid Leukemia in First Remission. N Engl J Med. 2020 Dec 24;383(26):2526-2537.
- Avvisati G. How I treat newly diagnosed acute promyelocytic leukemia. Mediterranean Journal of Hematology and Infectious Diseases. 2011; 3, 1 (Dec. 2011), e2011064
- Cicconi L et al. PML-RARA kinetics and impact of FLT3-ITD mutations in newly diagnosed acute promyelocytic leukemia treated with ATRA and ATO or ATRA and chemotherapy. Leukemia. 2016:30:1987-1992
- Ganzel C, et al. Autologous transplant remains the preferred therapy for relapsed APL in CR2. BMT. 2016:51:1180-1183.
- Lo-Coco F, Cicconi L, Breccia M. Current treatment of adult acute promyelocytic leukemia. J.Haematol. 2016:172:841-854.
- Lo-Coco F et al. Retinoic acid and arsenic trioxide for acute promyelocytic leukemia. NEJM 2014:369:111-121.
- Montesinos P, et al. Differentiation syndrome in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline chemotherapy: characteristics, outcome, and prognostic factors. Blood. 2009 Jan 22;113(4):775-83.
- Paulson Ket al. Acute promyelocytic leukemia is characterized by stable incidence and improved survival that is restricted to patients managed in leukemia referral centres: pan-Canadian epidemiological study.Br.J.Haematol. 2014:166: 660–666.
- Platzbecker Uet al. Improved outcomes with retinoic acid and arsenic trioxide compared with retinoic acid and chemotherapy in non-high-risk acute promyelocytic leukemia : final results of the randomized Italian-German APL0406 trial. JCO. 2017:35:605-612.
- Sanz MA et al. Management of acute promyelocytic leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood 2009;113:1875-91.
- Sanz MA et al. All-trans retinoic acid and anthracycline monochemotherapy for the treatment of elderly patients with acute promyelocytic leukemia. Blood 2004;104:3490-3.
- Bernard E, et al. Implications of TP53 allelic state for genome stability, clinical presentation and outcomes in myelodysplastic syndromes. Nat Med. 2020 Oct;26(10):1549-1556.
- Taylor J, et al. Multicenter analysis of outcomes in blastic plasmacytoid dendritic cell neoplasm offers a pretargeted therapy benchmark. Blood. 2019; 134(8): 678-687
- Laribi K. et al. Blastic plasmacytoid dendritic cell neoplasms: results of an international survey on 398 adult patients. Blood adv 2020; 4(19): 4838-4848
- Zuckerman, et al. How I treat haematologic emergencies in adults with acute leukemia. Blood 2012; 12 1993-2002
- Wolach O and Stone RM. Optimal therapeutic strategies for mixed phenotype acute leukemia. Curr Opin Hematol 2020; 27:95-102
- Fernandez HF, et al. Autologous transplantation gives encouraging results for young adults with favorable-risk acute myeloid leukemia, but is not improved with gemtuzumab ozogamicin. Blood 2011;117:5306-5313.
- Ofran Y, Tallman MS, Rowe JM. How I treat acute myeloid leukemia presenting with preexisting comorbidities. 2016 ; 128(4):488-496
- Löwenberg B, et High-dose daunorubicin in older patients with acute myeloid leukemia. N Engl J Med. 2009;361:1235-48.
- Klepin HD, Rao AV, Pardee Acute myeloid leukemia and myelodysplastic syndromes in older adults. J Clin Oncol 2014;32:2541-52.
- DiNardo CD, et al. Azacitidine and Venetoclax in Previously Untreated Acute Myeloid Leukemia, NEJM. 2020 Aug 13, 383 (7), 617-29
- Jonas BA, Pollyea DA. How we use venetoclax with hypomethylating agents for the treatment of newly diagnosed patients with acute myeloid leukemia.Leukemia. 2019 Dec;33(12):2795-2804.
- DiNardo CD, et al. 10-day decitabine with venetoclax for newly diagnosed intensive chemotherapy ineligible, and relapsed or refractory acute myeloid leukaemia: a single-centre, phase 2 trial. Lancet Haematol 2020; 7: e724-36
- Blum W, et al. Clinical response and miR-29b predictive significance in older AML patients treated with a 10-day schedule of decitabine. Proc Natl Acad Sci U S A 2010;107:7473-8.
- Burnett AK, et al. A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic acid for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment. Cancer 2007;109:1114-24.
- Dombret H, et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood 2015;126:291-9.
- Fenaux P, et al. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: a randomised, open-label, phase III study. International Vidaza High-Risk MDS Survival Study Group. Lancet Oncol 2009;10:223-32.
- van der Helm L, et al. Overexpression of p53 is associated with poor survival, but not with reduced response to hypomethylating agents in older patients with acute myeloid leukemia. Br J Haematol 2016.
- van der Helm L, et al. Azacitidine might be beneficial in a subgroup of older AML patients compared to intensive chemo-therapy: a single centre retrospective study of 227 consecutive patients. J Hematol Oncol 2014;6:29.
- Kantarjian HM, et al. Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia. J Clin Oncol 2012;30:2670-7.
- Quintas-Cardama A, et al. Epigenetic therapy is associated with similar survival compared with intensive chemotherapy in older patients with newly diagnosed acute myeloid leukemia. Blood. 2012;120:4840-5.
- Ritchie EK, et al. Decitabine in patients with newly diagnosed and relapsed acute myeloid leukemia. Leuk Lymphoma 2013;36:407-12.
- Ferrara F, et al. Consensus-based definition of unfitness to intensive chemotherapy in acute myeloid leukemia: a project of SIE, SIES and GITMO group on a new tool for therapy decision making. Leukemia 2013; 27, 997-999
- Cortes JE, Heidel FH, Hellmann A, et al. Randomized comparison of low dose cytarabine with or without glasdegib in patients with newly diagnosed acute myeloid leukemia or high-risk myelodysplastic syndrome. Leukemia. 2019: 33(2):379-389
- Sorror ML, et Long-term outcomes among older patients following nonmyeloablative conditioning and allogeneic hemato¬poietic cell transplantation for advanced hematologic malignancies. JAMA 2011; 306:1874-83.
- Sorror ML, et al. Comorbidity-age index: a clinical measure of biological age before allogeneic hematopoietic cell transplantation. J Clin Oncol 2014;32:3249-56.
- Vellenga E, van Putten W, Ossenkoppele GJ, et Autologous peripheral blood stem cell transplantation for acute myeloid leukemia. Blood 2011;118:6037-42.
- Versluis J, et Prediction of non-relapse mortality in recipients of reduced intensity conditioning allogeneic stem cell transplantation with AML in first complete remission. Leukemia 2015;29:51-57.
- Cornelissen JJ, et al. The European LeukemiaNet AML Working Party consensus statement on allogeneic HSCT for patients with AML in remission: an integrated-risk adapted approach. Nat Rev Clin Oncol. 2012:9:579-90.
- Versluis J, et al. Post-remission treatment with allogeneic stem cell transplantation in patients aged 60 years and older with acute myeloid leukemia: a time- dependent analysis. Lancet Haematol 2015; 2:e427-36.
- Cornelissen JH, et al. Comparative analysis of the value of allogeneic hematopoietic stem-cell transplantation in acute myeloid leukemia with monosomal karyotype versus other cytogenetic risk categories. J Clin Oncol 2012;30:2140-46.
- Ivey et al. Assessment of Minimal Residual Disease in Standard-Risk AML. N Engl J Med 2016; 374:422-33
- Gorin NC, et al. Optimizing the pretransplant regimen for autologous stem cell transplantation in acute myelogenous leukemia: Better outcomes with busulfan and melphalan compared with busulfan and cyclophosphamide in high risk patients autografted in first complete remission: A study from the acute leukemia working party of the EBMT. Am J Hematol. 2018;93:859–866
- Araki D, et al. Allogeneic Hematopoietic Cell Transplantation for Acute Myeloid Leukemia: Time to Move Toward a Minimal Residual Disease-Based Definition of Complete Remission? J Clin Oncol. 2016 Feb 1;34(4):329-36.
- Thol F, et al. How I treat refractory and early relapsed acute myeloid leukemia. 2015 Jul 16;126(3):319-27.
- DeWolf S and Tallman MS. How I treat relapsed or refractory AML. Blood. 2020;136(9):1023-1032)
- Ganguly Set al. Decitabine in patients with relapsed acute myeloid leukemia (AML) after allogeneic stem cell transplantation (allo-SCT). Ann Hematol. 2013; 92(4):549–550
- Schmid C et al. Treatment, risk factors, and outcome of adults with relapsed AML after reduced intensity conditioning for allogeneic stem cell transplantation. 2012; 119 (6):1599-1606
- Schroeder T et al. Azacitidine and donor lymphocyte infusions as first salvage therapy for relapse of AML or MDS after allogeneic stem cell transplantation. 2013; 27(6):1229–1235
- Schmid C, Schleuning M, Schwerdtfeger R, et al. Long-term survival in refractory acute myeloid leukemia after sequential treatment with chemotherapy and reduced-intensity conditioning for allogeneic stem cell transplantation. 2006;108:1092–9.
- Breems DA et al. Prognostic index for adult patients with acute myeloid leukemia in first relapse. J Clin Oncol. 2005;23(9):1969-1978
- Craddock C, Labopin M, Robin M, et al. Clinical activity of azacitidine in patients who relapse after allogeneic stem cell transplantation for acute myeloid leukemia. 2016;101:879e883.
- Perl AE et al. Gilteritinib or chemotherapy for relapsed or refractory FLT3-mutated AML. N Engl J Med. 2019;381: 1728e1740
- Stein EM, et al. Enasidenib in mutant IDH2 relapsed or refractory acute myeloid leukemia. Blood 2017 aug 10; 130(6): 722-731
- Sievers EL, et al. Efficacy and Safety of Gemtuzumab Ozogamicin in Patients With CD33-Positive Acute Myeloid Leukemia in First Relapse. J Clin Oncol 19:3244-3254
- Bewersdorf JP et al. Venetoclax as monotherapy and in combination with hypomethylating agents or low dose cytarabine in relapsed and treatment refractory acute myeloid leukemia: a systematic review and meta-analysis. 2020 Nov 1;105(11):2659-2663.
- Stahl M, et al. Hypomethylating agents in relapsed and refractory AML: outcomes and their predictors in a large international patient cohort. Blood Adv. 2018;2(8):923-932.
- Schroeder T, et al. Azacitidine and donor lymphocyte infusions as first salvage therapy for relapse of AML or MDS after allogeneic stem cell transplantation. Leukemia. 2013: 27;1229–1235.
- Sommer S, et al. Decitabine in combination with donor lymphocyte infusions can induce remissions in relapsed myeloid malignancies with higher leukemic burden after allogeneic hematopoietic cell transplantation. Leuk Res. 2018:72:20-26.
- Cicconi L, Breccia M, Franceschini L, et al. Prolonged treatment with arsenic trioxide (ATO) and all-trans-retinoic acid (ATRA) for relapsed acute promyelocytic leukemia previously treated with ATRA and chemotherapy. Ann. Hematol. 2018;97(10):1797–1802.
- Ivey A, Hills RK, et al. Assessment of minimal residual disease in standard- risk AML. 2016:374:422-433.
- Terwijn M, et al. High prognostic impact of flow cytometric minimal residual disease detection in acute myeloid leukemia: data from the HOVON/SAKK AML 42A study. J Clin Oncol. 2013 Nov 1;31(31):3889-97.
- Schuurhuis GJ, et al. Minimal/ measurable residual disease in AML: a consensus document from the European LeukemiaNet MRD Working Party. 2018 Mar 22;131(12):1275-1291
- Röllig C and Ehninger G. How I treat hyperleukocytosis in acute myeloid leukemia. Blood 2015(may), 125 (21): 3246-3252
- Stahl M., et al. Management of hyperleukocytosis and impact of leukapheresis among patients with acute myeloid leukemia (AML) on short- and long-term clinical outcomes: a large, retrospective, multicenter, international study. Leukemia (2020) 34:3149–3160
- Bertoli S. et al. Dexamethasone in hyperleukocytotic acute myeloid leukemia. Haematologica 2018: 103(6): 988-998
- Ganzel et al. Extramedullary Disease in Adult Acute Myeloid Leukemia Is Common but Lacks Independent Significance: Analysis of Patients in ECOG-ACRIN Cancer Research Group Trials, 1980-2008, J Clin Oncol 2016: 34:3544-3553
- Zhang X, Zhang H, Chen L, Wang M, Xi J, Liu X, Xie M, Li D, Gulati ES, Gong S, Wang H. Arsenic trioxide and all-trans retinoic acid (ATRA) treatment for acute promyelocytic leukemia in all risk groups: study protocol for a randomized controlled trial. Trials. 2018 Sep 5;19(1):476
- Wang H. Arsenic trioxide and mannitol for the treatment of acute promyelocytic leukemia relapse in the central nervous system. 2014; 124: 1998–2000.
- Huls G et al. Richtlijn Acute promyelocytenleukemie (APL): richtlijnen voor diagnostiek en behandeling/ Guidelines Acute promyelocyten leukemia (APL): guidelines for diagnosis and treatment. Ned Tijdschr Hematol 2018; 15:396-401
- Gassparovic L, et al. Incidence of Differentiation Syndrome Associated with Treatment Regimens in Acute Myeloid Leukemia: A Systematic Review of the Literature. J. Clin. Med. 2020, 9, 3342
- Norsworthy KJ, et al. Differentiation Syndrome with Ivosidenib and Enasidenib Treatment in Patients with Relapsed or Refractory IDH-Mutated AML: A U.S. Food and Drug Administration Systematic Analysis. Cancer Res. 2020, 26
- IDH-DS guidance document for AG-221/enasidenib; version 3.1, 6 November 2017, Celgene Corporation
- Fathi et al, JAMA Oncol 2018. Differentiation Syndrome Associated With Enasidenib, a Selective Inhibitor of Mutant Isocitrate Dehydrogenase 2: Analysis of a Phase 1/2 Study
- Voorlichtingsbrochure over de risico’s van gilteritinib voor voorschrijvers. Astellas Pharma B.V. Versie 2.0 maart 2021
- Baker JW, Royer GL, Weiss RB. Cytarabine and neurologic toxicity. J Clin Oncol. 1991 Apr;9(4):679-93
- Nguyen P, et al. Azacitidine-induced pneumonitis and literature review. BMJ Case Rep. 2020 Oct 29;13(10):e236349
- Verriere B, et al. Azacitidine-Induced Interstitial Pneumonitis. Am J Ther. Sep-Oct 2016;23(5):e1205-8
- Alnimer Y, et al. Azacitidine-induced cryptogenic organizing pneumonia: a case report and review of the literature. J Med Case Rep. 2016 Jan 20;10:15.
- Tham RT, et al. Pulmonary complications of cytosine-arabinoside therapy: radiographic findings. AJR Am J Roentgenol. 1987:149:23-27.
- Churpek JE, Godley LA. How I diagnose and manage individuals at risk for inherited myeloid malignancies. Blood. 2016;128(14):1800-1813.
- Godley LA and Shimamura A. Genetic predisposition to hematologic malignancies: management and surveillance. Blood. 2017;130(4):424-432
- Raaijmakers MHGP et al. Genetische predispositie voor myeloïde maligniteiten: diagnostiek en beleid. Nederlands Tijdschrift voor Hematologie 5, 208-217, 2018
- Weinberg OK, et al. Germline Predisposition to Hematolymphoid Neoplasia. 2017 Society for Hematopathology/European Association for Haematopathology Workshop Report. Am J Clin Pathol. 2019 Aug; 152(3): 258–276
- Ernst MPT, et al. RUNX1 germline variants in RUNX1-mutant AML: How frequent? Blood 2020. Oct 19;
- Bloedtransfusiebeleid FMS 15-10-202