Multipel myeloom, in Nederland vaak ziekte van Kahler genoemd, is een aandoening waarbij er sprake is van een kwaadaardige woekering van plasmacellen. Deze woekering vindt plaats in het beenmerg en gaat met een scala van symptomen gepaard.

Dia 1
Dia 2

Dia 3
Dia 4
Dia 5
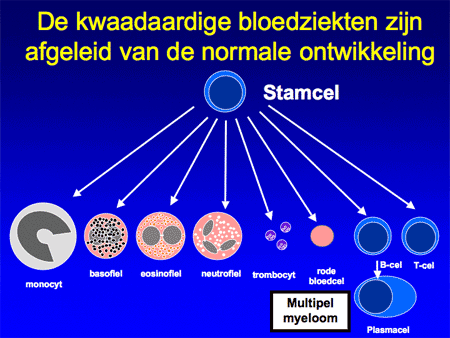
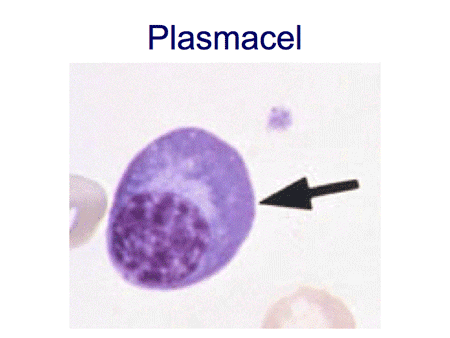
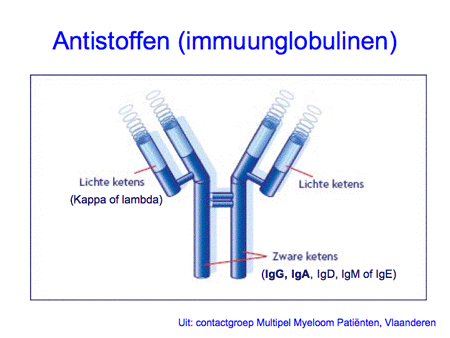
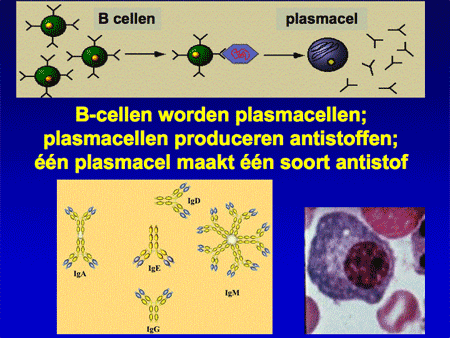
Om de ziekte te begrijpen is het belangrijk inzicht te hebben in de functie van normale plasmacellen. Plasmacellen zijn cellen die normaal voorkomen in het beenmerg, maar ook elders in het lichaam, zoals in de darmen, de luchtwegen of de lymfklieren. De plasmacellen ontstaan uit voorloper witte bloedcellen, zogenaamde B-lymfocyten of B-cellen (dia 2, 3, 4 en 5). Eenmaal uitgerijpt maken plasmacellen antistoffen, ook wel immuunglobulinen genoemd, die een belangrijke rol spelen in onze afweer. Antistoffen zijn eiwitten en ze zijn opgebouwd uit meerdere delen, de zware ketens en de lichte ketens. De zware ketens hebben een verschillende opbouw en worden verder aangeduid als IgG, IgA, IgM, IgD of IgE. De lichte ketens kunnen van het kappa- of het lambda-type zijn (dia 6 en 7).
Dia 6
Dia 7
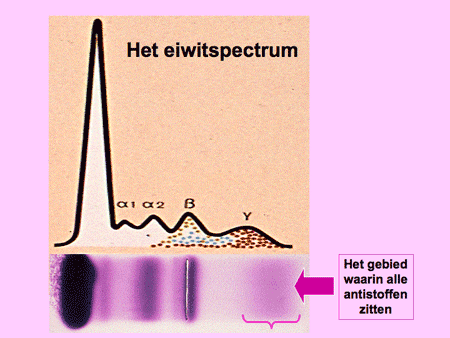
Elke plasmacel kan maar één type antistof maken. In ons lichaam worden duizenden verschillende soorten antistoffen aangemaakt door evenzoveel verschillende soorten plasmacellen. Dit mechanisme met zijn diversiteit zorgt ervoor dat wij normaliter goed beschermd zijn tegen de meeste soorten bacteriën of virussen. De antistoffen worden door de plasmacel uitgescheiden en komen in het bloed terecht. In het bloed kunnen ze bepaald worden door middel van het zogenaamde eiwitspectrum, een test waarbij het hele spectrum van antistoffen zichtbaar gemaakt kan worden (dia 8).
Dia 8
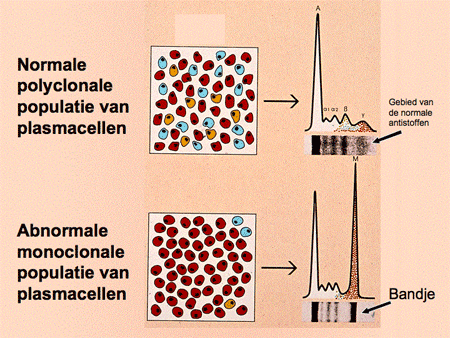
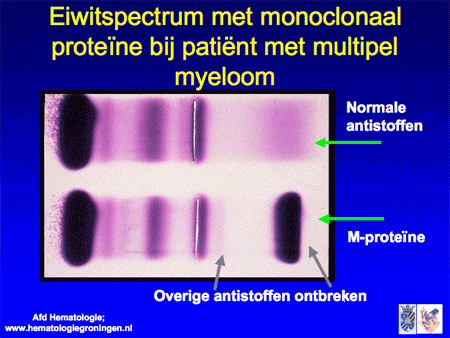
Als er een overmaat ontstaat (een ‘cloon’) van maar één soort plasmacellen, ontstaat er ook een overmaat van één soort antistoffen. Dit wordt een monoclonaal eiwit, M-proteïne genoemd. Een oudere naam die nog veel gebruikt wordt is paraproteïne, wat letterlijk ‘naast-eiwit’ betekent. Het M-proteïne is in de test van het eiwitspectrum herkenbaar als een scherpe band. Artsen zeggen vaak dat Kahler-patiënten ‘een band in het bloed hebben’, waarmee ze bedoelen dat er een M-proteïne aantoonbaar is (dia 9, 10 en 11). Behalve dat het monoclonale eiwit in het bloed te zien is, worden er soms delen van (alleen de lichte ketens) in de urine aangetroffen. Hieraan is de naam van Bence-Jones-eiwit verbonden.
Dia 9. Normale en abnormale populatie van plasmacellen
Dia 10

Dia 11
Niet elk M-proteïne is kwaadaardig
Het komt vaak voor dat bij gezonde personen een geringe hoeveelheid M-proteïne wordt aangetroffen. Het is een fenomeen dat zelfs bij meer dan 10 tot 15 procent van de 70-plussers gezien wordt. Het wordt beschouwd als een vorm van disbalans in de afweerontwikkeling, zonder dat het wijst op een kwaadaardige aandoening. Hieraan is de mooie naam MGUS verbonden: monoclonal gammopathy of unknown significance (dia 12). Als het om een heel geringe hoeveelheid gaat zonder dat een persoon klachten heeft, is het gerechtvaardigd om af te wachten. Mocht de hoeveelheid toenemen of mochten er wel klachten of andere symptomen zijn, dan is het noodzakelijk dat meer onderzoek gedaan wordt gericht op de aanwezigheid van bijvoorbeeld de ziekte van Kahler.

Dia 12
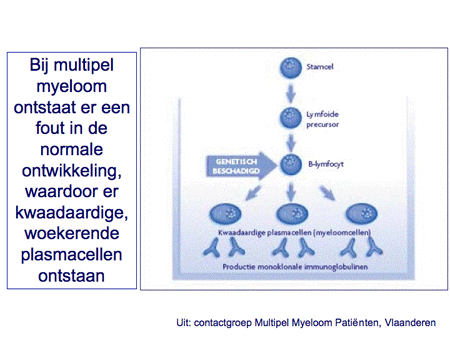
Dia 13
Hoe ontstaat het multipel myeloom en hoe vaak komt het voor?
Het is niet bekend hoe het multipel myeloom/de ziekte van Kahler kan ontstaan. Aangenomen wordt dat ergens in de ontwikkeling van voorlopercellen richting plasmacel fouten optreden die vervolgens aanleiding geven tot een ongecontroleerde groei van kwaadaardige plasmacellen (dia 13).
De ziekte van Kahler is zeldzaam en wordt per jaar bij ongeveer 6 nieuwe patiënten per 100.000 inwoners in Nederland gezien. De ziekte komt niet bij kinderen voor en is typisch een aandoening van oudere volwassenen. De helft van de patiënten is ouder dan 65 jaar; de ziekte komt even vaak bij vrouwen als bij mannen voor.
Symptomen
De symptomen kunnen zeer divers zijn, variërend van nauwelijks afwijkingen tot zeer ernstige ziekteverschijnselen. Door de woekering van plasmacellen in het beenmerg (zie dia 15) kunnen de botten worden aangetast. Het beenmerg is immers aanwezig in de botten. De botaantasting kan bestaan uit algehele botontkalking (osteoporose), met daarbij het risico op botbreuken of wervelinzakking. Behalve diffuse botaantasting kunnen er ook plaatselijke myeloomhaarden ontstaan (dia 17), die vaak met botpijn gepaard gaan of zelfs tot spontane botbreuken kunnen leiden. Meestal zijn de aantastingen zichtbaar op gewone botfoto’s (X-skelet), maar soms is een MRI-scan nodig om de aantasting zichtbaar te maken.

Dia 14
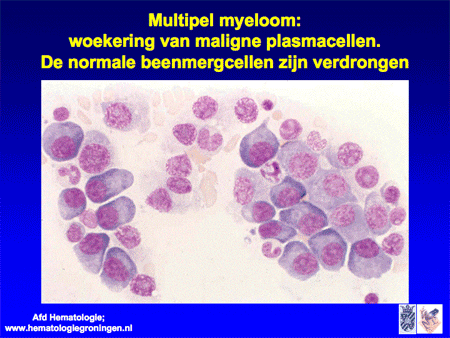
Dia 15

Dia 16
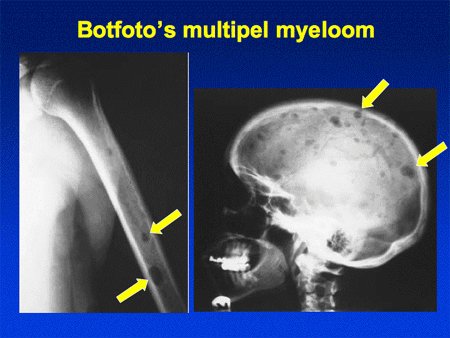
Dia 17. Botfoto’s bij multipel myeloom
Bij de botaantasting kan kalk vrijkomen, wat leidt tot een verhoging van het kalkgehalte in het bloed (hypercalciëmie genoemd). Dit is een levensgevaarlijke aandoening waarbij patiënten eerst dorst hebben en te veel gaan plassen, vervolgens uitgedroogd raken, meestal met ernstige obstipatie, verward en versuft worden en nierbeschadiging ontwikkelen.
Door de beenmergaantasting, vooral als deze ernstig is, kan een tekort aan de normale bloedelementen optreden (dia 15). Daarbij kan bloedarmoede ontstaan, met tevens een tekort aan witte bloedcellen (verhoogd risico op infecties) en een tekort aan bloedplaatjes (bloedingsneiging).
Tot slot maken de kwaadaardige plasmacellen factoren die de achtergebleven normale plasmacellen onderdrukken. Daardoor ontstaat een tekort aan normale antistofproductie (hypogammaglobulinemie) met een extra sterk verhoogd risico op infecties, vooral van de luchtwegen (longontsteking, neusbijholteontsteking).
Als het M-proteïnegehalte erg hoog is, kan er een hyperviscositeitssyndroom ontstaan: een ziektebeeld veroorzaakt door een toegenomen stroperigheid van het bloed. Dit gaat meestal gepaard met sufheid, hoofdpijn, klachten van het gezichtsvermogen en kortademigheid bij inspanning.
Hoe wordt de diagnose gesteld?
Allereerst wordt met bloedonderzoek onderzocht of er een M-proteïne is, of de nierfunctie normaal is, hoe het kalkgehalte is en wat de waarden van de bloedcellen zijn. De urine moet nagekeken worden op de aanwezigheid van het Bence-Jones-eiwit. Als speciale testen (zie Stadiumindeling) moeten het bèta-2-microglobulinegehalte en het albuminegehalte gemeten worden.
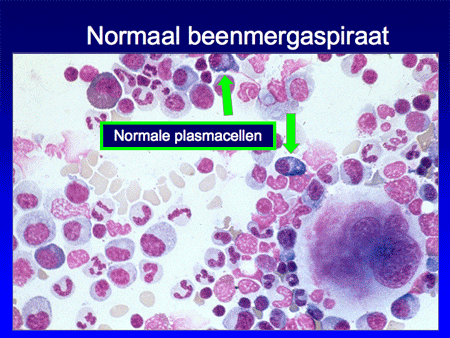
Het belangrijkste onderzoek daarna is een beenmergonderzoek. Wanneer normaal beenmerg, na een beenmergpunctie verkregen, onder de microscoop bekeken wordt, is er sprake van een heel divers beeld waarin alle verschillende celsoorten gezien kunnen worden, waaronder ook enkele plasmacellen (dia 5). In het normale geval zal het percentage plasmacellen minder dan 5 procent zijn. Bij een infectie neemt het percentage toe, als uiting van versterkte afweer. Bij het multipel myeloom/de ziekte van Kahler zal het percentage echter nog veel hoger zijn, variërend van 20 tot soms wel meer dan 60 tot 70 procent. In dat laatste geval zal de normale bloedcelaanmaak ook in het gedrang komen (dia 15), waardoor er een tekort ontstaat aan de normale bloedelementen.
Tegelijk met het beenmergonderzoek zal chromosomenonderzoek (cytogenetisch onderzoek) gedaan moeten worden, omdat eventuele afwijkingen op dit gebied belangrijk zijn voor de prognose en het eventuele behandelplan.
Gebruikelijk is om bij potentiële Kahler-patiënten skeletfoto’s te maken van de botten om eventuele botaantasting en/of botontkalking zichtbaar te maken.
Stadiumindeling
Tot enige jaren terug werden Kahler-patiënten ingedeeld volgens de zogenaamde Salmon-en-Durie-classificatie, waarbij rekening gehouden werd met de hoogte van het M-proteïne- en Bence-Jones-eiwitgehalte, de aan- of afwezigheid van bothaarden, de aanwezigheid van bloedarmoede en een eventuele nierbeschadiging. Recent echter is de stadiumindeling veranderd:
| Stadium | β2-microglobuline (mg/l) | Albumine (g/l) |
|---|---|---|
| I | < 3.5 | ≥ 35 |
| II | geen stadium I of III | |
| III | ≥ 5.5 |
Behandeling van het multipel myeloom/de ziekte van Kahler
De behandeling wordt onderscheiden in een algemeen deel en een specifiek deel. Het algemene deel bestaat uit:
- immobilisatie vermijden: hoe minder in bed, hoe beter;
- conditieverbetering (wandelen, zwemmen, evt. fietsen);
- spieroefeningen, gericht op versterking van onder meer de rugspieren;
- pijnbestrijding;
- voldoende vochtintake (ten minste 2,5 liter/24 uur);
- profylaxe botafwijkingen: bisfonataten, bijvoorbeeld APD-infusie (één keer per maand, gedurende 12 tot 24 maanden);
- bestrijding van hypercalciëmie d.m.v. zoutinfuus (4 tot 6 liter per 24 uur);
- eventueel hemodialyse bij sterk gestoorde nierwerking.
Specifieke behandeling: er zijn verschillende manieren om de kwaadaardige cellen kwijt te raken. Hiertoe worden gerekend:
- chemotherapie (melfalan, cyclofosfamide (endoxan), vincristine, adriamycine);
- corticosteroïden, met name dexamethason en prednisolon;
- bloedvatgroeiremmers (thalidomide, lenalidomide en pomalidomide);
- eiwitafbraakremmers (bortezomib (velcade) of carfilzomib).
Wat de chemotherapie betreft, deze medicijnen zullen de kwaadaardige plasmacellen, myeloomcellen genoemd, doden, maar tijdelijk ook de gewone bloed- en beenmergcellen. Gelukkig zijn deze laatste meestal sterker dan myeloomcellen en zullen deze steeds tussendoor kunnen herstellen.
De zwaarte van de chemotherapie hangt af van de leeftijd van de patiënt. Patiënten ouder dan 65 jaar worden meestal behandeld met een combinatie van chemotherapie (bijvoorbeeld melfalan), dexamethason of thalidomide/lenalidomide. Hoe jonger, hoe intensiever de behandeling bij voorkeur zal zijn. Patiënten jonger dan 65 jaar krijgen kuren bestaande uit elke maand een infuusbehandeling (meestal een combinatie van bortezomib en cyclofosfamide of adriamycine en vincristine) en dexamethasontabletten. Na een aantal kuren (meestal drie tot vier) volgt een korte opname om voorbereidingen te treffen en stamcellen te verzamelen voor een autologe stamceltransplantatie.
Bij een stamceltransplantatie wordt een patiënt met een zeer hoge dosis chemotherapie behandeld. Het doel is om hiermee zoveel mogelijk myeloomcellen te doden, iets wat onvoldoende lukt met gewone chemotherapie. Door de hoge dosis zullen de eigen beenmerg- en bloedcellen blijvend beschadigd raken, maar daar is een oplossing voor, door de stamcellen, verantwoordelijk voor de beenmerg- en bloedcelvorming, van tevoren te verzamelen en in te vriezen. Voor meer informatie over autologe stamceltransplantatie, zie Stamceltransplantatie.
Wanneer de stamcellen verzameld zijn, volgt een langdurige opname van circa 4 weken, waarbij hoge doses melfalan worden toegediend gevolgd door teruggave van de eigen ingevroren stamcellen. Wanneer voldoende herstel is opgetreden en de patiënt weer naar huis kan, wordt een nabehandeling gestart met een onderhoudstherapie.

Dia 18

Dia 19
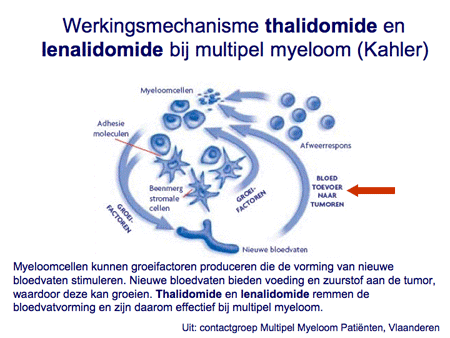
Dia 20

Dia 21

Dia 22
Multipel myeloom-behandeling en HOVON-studies
Hoewel de behandelingsresultaten de laatste jaren sterk zijn verbeterd, zijn we nog niet tevreden. Zolang niet alle patiënten uiteindelijk kunnen genezen, valt er nog veel te doen. Daarom streven wij ernaar alle patiënten waar mogelijk in studieverband te behandelen. Bij elke studie wordt getracht de behandeling verder te verbeteren. In een dergelijke studie is het principe dat er twee of drie behandelingsmogelijkheden zijn. Daarbij wordt de potentieel betere behandeling vergeleken met de – tot nu toe – beste zogenaamde gouden standaardtherapie. Als een patiënt toestemming geeft voor een dergelijke studie, zal het lot vervolgens bepalen welk behandelingsschema wordt gegeven.
Soms zijn we te optimistisch en blijkt de potentieel betere behandeling niet beter te zijn en een enkele keer zelfs meer bijwerkingen te veroorzaken dan de therapie tot dusver. Gelukkig gaat het vaak ook goed en blijken we stapje voor stapje (per studie) kleine verbeteringen te kunnen aanbrengen. Dit is dan ook de reden dat de overlevingskansen van het multipel myeloom de laatste jaren zo verbeterd zijn. Jaren geleden werd, onder meer binnen de HOVON (zie www.hovon.nl), onderzocht of het zinvol was stamceltransplantatie aan te bieden aan myeloom-patiënten. Toen dat beter bleek te zijn, is het vervolgens onderdeel geworden van de therapie. Het standaard toevoegen van bijvoorbeeld een stamceltransplantatie aan de ‘gewone’ chemotherapiekuren heeft ervoor gezorgd dat mensen langer zonder symptomen kunnen leven, ook al is het nog niet de ideale definitief genezende therapie gebleken. Hiermee profiteren de huidige patiënten van het feit dat hun voorgangers aan studies hebben meegewerkt. Met alle nieuwe middelen zijn de resultaten de laatste jaren zó verbeterd dat nu een studie gaat starten die gaat onderzoeken of een stamceltransplantatie uitgesteld kan worden in plaats van meteen aangeboden bij de beginbehandeling!
Wij vinden het erg belangrijk dat dit soort studies uitgevoerd worden. De afdeling Hematologie van het UMCG werkt actief aan al deze HOVON-studies mee. De kans is dan ook groot dat een nieuwe patiënt met een multipel myeloom/de ziekte van Kahler met de vraag geconfronteerd wordt of deze mee wil doen aan een lopende myeloom-studie. Alle informatie over zo’n studie wordt altijd op schrift verstrekt en er is meestal ruim bedenktijd voor een dergelijke belangrijke beslissing.
Wat als het multipel myeloom na de eerste behandeling opnieuw actief wordt?
Er zijn, zelfs na een vroegere stamceltransplantatie, nog veel mogelijkheden om de ziekte opnieuw te onderdrukken, ook al zal dat meestal geen genezing maar verlenging van de symptoomvrije periode betekenen. Als de transplantatie erg lang geleden heeft plaatsgevonden en als er nog stamcellen van de eerste periode overgebleven zijn, heeft het zin nog een keer de hoge dosis melfalan te geven en de transplantatie te herhalen. Maar er zijn ook meerdere andere opties, zoals bortezomib, combinaties met thalidomide, of lenalidomide. Het multipel myeloom staat de laatste jaren erg in de belangstelling, wat betekent dat er veel nieuwe middelen onderzocht worden of op de markt komen. Patiënten met een multipel myeloom/de ziekte van Kahler kunnen de toekomst dan ook met een gematigd optimisme tegemoet zien.
Hulp en ondersteuning tijdens en na therapie
Contactgroep Hematon, Myeloom en Waldenström (CMWP), deze is onderdeel geworden van de overkoepelende vereniging HEMATON voor patiënten met bloedkanker, lymfklierkanker, multipel myeloom en voor patiënten die een stamceltransplantatie hebben ondergaan.
Stichting Hematon
Postbus 8152
3503 RD Utrecht
Tel. 030-760 34 60
E-mail: secretariaat@hematon.nl
Website: www.hematon.nl
Andere informatieve websites voor patiënten zijn:
- International Myeloma Foundation: myeloma.org
- Multiple Myeloma Research Foundation: themmrf.org
Daarnaast is er voor patiënten die de behandeling achter de rug hebben en moeite hebben de draad weer op te pakken, de mogelijkheid gebruik te maken van het revalidatieprogramma Herstel & Balans. Dit programma is op zestig locaties in Nederland beschikbaar, onder meer ook in het UMCG, via het Centrum voor Revalidatie, locatie Beatrixoord. Dit programma is gericht op het verminderen van klachten zoals vermoeidheid, pijn, angst en neerslachtigheid. Daardoor verbetert de kwaliteit van leven.
Een (ex-)patiënt kan aan Herstel & Balans deelnemen nadat de behandelingen tegen kanker zijn afgerond. Bij de start van de revalidatie moet de conditie zodanig zijn dat de persoon zich redelijk kan bewegen en aan het groepsprogramma kan deelnemen. De arts kan de patiënt verwijzen naar Herstel & Balans als de behandeling is afgerond en de kans op herstel aannemelijk is.
Veel zorgverzekeraars vergoeden de revalidatie via de aanvullende verzekering.
Nazorg: Het Behouden Huys
Het Behouden Huys
Psycho-oncologisch therapiecentrum
Rijksstraatweg 363-a
9752 CH Haren
Tel. 050-4062400
www.behoudenhuys.nl




