Oorsprong van de ziekte en symptomen
Een non-Hodgkin-lymfoom is een zeldzame vorm van lymfklierkanker die op alle leeftijden kan voorkomen en die bij een deel van de patiënten volledig te genezen is. De naam Hodgkin stamt af van de arts Thomas Hodgkin, die in de negentiende eeuw de ziekte van Hodgkin – nu officieel Hodgkin-lymfoom genoemd – voor het eerst beschreef. Nadien bleken er vele varianten van de ziekte van Hodgkin te bestaan, die gemakshalve maar non-Hodgkin-lymfoom (letterlijk ‘niet-Hodgkin-lymfoom’) werden genoemd, afgekort tot NHL. Er bestaan wel zo’n 30 tot 40 verschillende soorten, die zeer verschillend zijn qua gedrag, presentatie in het lichaam en gevoeligheid voor therapie. Dat maakt het ook heel moeilijk om goede informatie over een NHL te geven. In deze tekst gaat het dan ook vooral over de hoofdlijnen en worden alleen de grote groepen en meest voorkomende beelden besproken.
In Nederland wordt jaarlijks bij 20 nieuwe patiënten per 100.000 inwoners, dat wil zeggen zo’n 3000 tot 4000 nieuwe patiënten per jaar, de diagnose non-Hodgkin-lymfoom gesteld.
De oorzaak van het non-Hodgkin-lymfoom is niet bekend. Er zijn een paar zeldzame vormen waar virussen een rol spelen, en die kunnen ontstaan bij patiënten met een aangeboren afweerstoornis of tijdens behandelingen die de afweer onderdrukken, zoals na nier-, hart-, long- of levertransplantatie. Het gaat in alle gevallen om kwaadaardige aandoeningen uitgaande van cellen die afstammen van de lymfocyten, een bepaald type witte bloedcellen die een rol spelen in onze afweer.
Het non-Hodgkin-lymfoom omvat dus een grote groep wezenlijk andere ziekten dan het Hodgkin-lymfoom (zie dia 2, 3 en 4). De ziekte ontstaat op één plaats in het lichaam, meestal in een lymfklier (dia 5) of in het beenmerg en breidt zich vervolgens verder uit in de loop van maanden tot jaren. Aangezien lymfocyten zich van nature door het hele lichaam verspreiden, kunnen NHL-cellen zich behalve in de lymfklieren ook nestelen in de milt, de lever, het beenmerg en opvallend vaak ook in vele andere organen (dia 11, 12, 13, 14 en 15). We kunnen het zo gek niet bedenken of er kan op een bepaalde plaats in het lichaam wel een NHL ontstaan. Voorbeelden van een NHL buiten de lymfklieren zijn bijvoorbeeld NHL’s van de huid, van de maag of darm, van de botten, in de hersenen, et cetera. Lokalisatie van een NHL buiten de lymfklieren wordt ook wel extranodale lokalisatie genoemd (dia 11, 12 en 15). Dit betekent dan ook dat vrijwel elk type arts/medisch specialist te maken kan hebben met een patiënt die zich presenteert met een NHL.

Dia 1

Dia 2

Dia 3

Dia 4
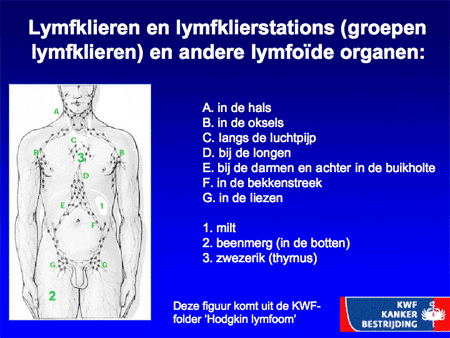
Dia 5
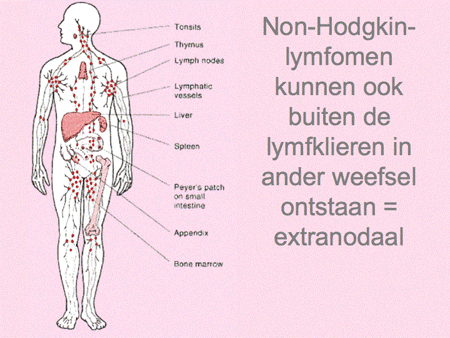
Dia 11
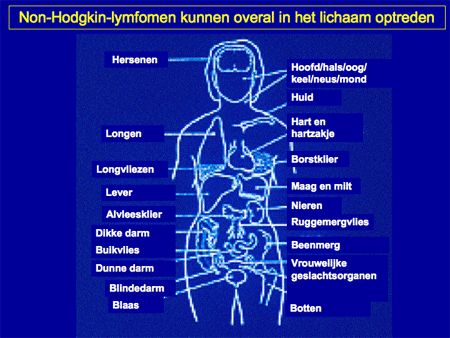
Dia 12

Dia 13
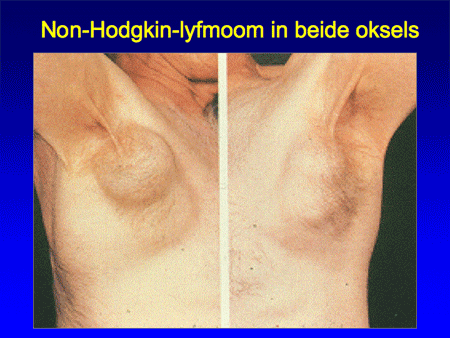
Dia 14
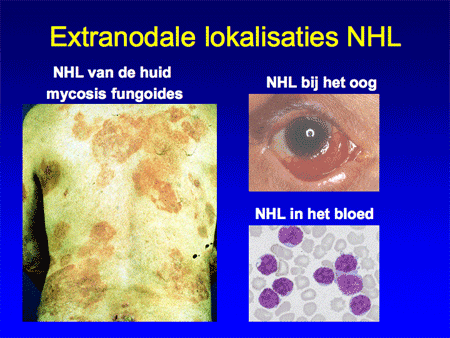
Dia 15

Dia 16
Een deel van de patiënten met een non-Hodgkin-lymfoom heeft weinig klachten en meldt zich met een opgezette lymfklier. Vaak wordt daarbij een zwelling in de hals, boven het sleutelbeen, onder de oksel of in de liezen gezien, die pijnloos is en soms snel groeit, maar meestal maar langzaam groter wordt. Als er wel klachten zijn, kunnen die bestaan uit plaatselijke of algemene klachten. Plaatselijke klachten worden bepaald door de lokalisatie van het NHL. Afhankelijk van de plek waar het NHL begint, kunnen de klachten bestaan uit maag- of buikpijn (lokalisatie in de maag, milt of de buik), huidafwijkingen (lokalisatie in de huid), klachten van de keel of neus (lokalisatie in de keelamandelen, mondholte of neus-/bijholten), benauwdheid (lokalisatie van NHL-klieren achter de longen (in het mediastinum) of bijvoorbeeld verwardheid (lokalisatie in de hersenen). Bij algemene symptomen kan er sprake zijn van onbegrepen ernstig gewichtsverlies (meer dan 10 procent van het oorspronkelijke gewicht) bij meestal goede eetlust, profuus nachtzweten (kletsnat wakker worden waarbij kleding en beddengoed verschoond moet worden) of onbegrepen koorts.
Hoe wordt een non-Hodgkin-lymfoom aangetoond?
De diagnose non-Hodgkin-lymfoom wordt gesteld door een biopt (weefselstukje) uit een afwijkende lymfklier of een andere aangedane plek te nemen en vervolgens onder de microscoop te laten beoordelen. Soms is de ziekte goed te herkennen door de patholoog (de arts-specialist die de lymfklier microscopisch onderzoekt), maar vaak is het beeld moeilijk, omdat er immers zo veel verschillende soorten bestaan. Dit vereist specifieke deskundigheid. Gespecialiseerde pathologen werken vooral in de universitaire ziekenhuizen en kankerziekenhuizen. Ook bepaalde infecties of ontstekingen kunnen soms verraderlijk veel op een NHL lijken. In het UMCG eisen wij dan ook altijd dat de diagnose gereviseerd (herbeoordeeld) wordt door een van onze pathologen die gespecialiseerd zijn op dit gebied. Dit betekent niet dat er een nieuw biopt genomen moet worden. Het materiaal van het oorspronkelijke biopt wordt door de lokale patholoog opgestuurd naar het UMCG, waar zo nodig aanvullende kleuringen gedaan worden om de diagnose te bevestigen en het specifieke subtype NHL vast te stellen.

Dia 6

Dia 7
Onderzoek bij een patiënt met een non-Hodgkin-lymfoom: stadiumindeling en risicoprofiel
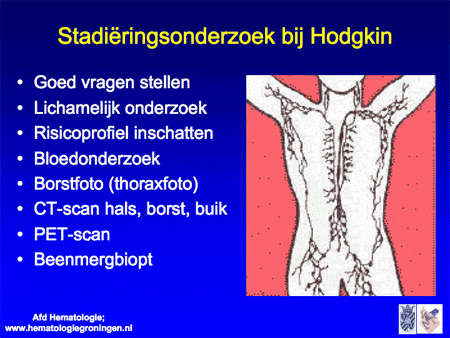
Wanneer met een lymfklierbiopt de diagnose NHL is gesteld, moet vervolgens worden vastgesteld op welke lokalisaties in het lichaam eventueel nog meer NHL aanwezig is. Dit onderzoek heet stadiëringsonderzoek (dia 8, 9 en 10) en omvat de volgende onderdelen:
- vragen stellen, met name gericht op de aan- of afwezigheid van algemene symptomen;
- lichamelijk onderzoek (waarmee een aantal uitwendige lymfklieren al onderzocht kan worden);
- bloedonderzoek;
- borstfoto (thoraxfoto);
- CT-scan van hals, borst en buik;
- soms een PET-scan of geïntegreerde PET-CT-scan;
- beenmergonderzoek;
- afhankelijk van de specifieke lokalisatie: aanvullende testen (bijvoorbeeld maagonderzoek, onderzoek door KNO-arts, maag-darmarts of neuroloog, et cetera);
- afhankelijk van de te starten behandeling is het soms zinvol onderzoek te doen naar de functie van hart en longen, vooruitlopend op eventuele bijwerkingen van de therapie.
Dia 8
Dia 9
Dia 10
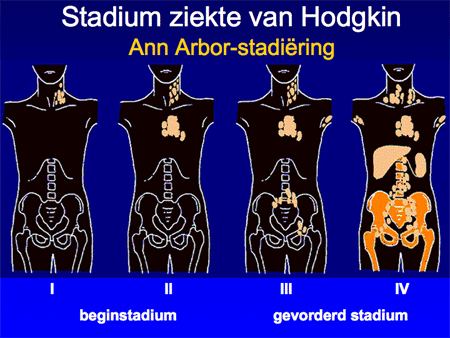
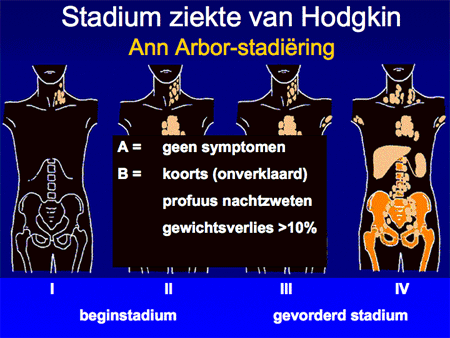
Aan de hand van alle gegevens wordt een patiënt vervolgens ingedeeld in een stadium, variërend van stadium I tot en met IV. Afhankelijk van de aan- of afwezigheid van algemene symptomen zoals koorts, nachtzweten of gewichtsverlies wordt daar nog een letter A (geen symptomen) of B (wel symptomen) aan toegevoegd. In de nabije toekomst zal dit begrip (B symptomen) overigens afgeschaft gaan worden, omdat het vaak moeilijk meetbaar is, en bovendien met de nieuwe therapie-mogelijkheden ook minder voorspellend is geworden voor de uitkomst van de behandeling. Deze viertraps stadiumindeling is ooit in de plaats Ann Arbor ontwikkeld en heet daarom ook wel Ann Arbor-stadiumindeling. Het systeem is simpel (dia 9 en 10) en benoemt het aantal aangedane lymfklierstations, of deze aan een zijde of aan beide zijden van het middenrif aanwezig zijn en of er lokalisaties zijn buiten deze lymfklierstations.
Het stadium alleen is niet voldoende om te kunnen vaststellen wat de beste behandeling is bij een bepaald type NHL. Daarvoor is ook het zogenaamde risicoprofiel van een patiënt belangrijk. Hieraan is de naam IPI verbonden. IPI staat voor International Prognostic Index, en deze index is samengesteld uit een aantal factoren zoals leeftijd, stadium, conditie van de patiënt, bloedonderzoek en type lokalisaties. Oudere patiënten (ouder dan 60 jaar) kunnen sommige vormen van therapie slechter verdragen dan jongere. Bepaalde afwijkingen in het bloed (bijvoorbeeld verhoogd serum LDH) maken de prognose (de kans op succes en overleving) minder goed dan wanneer het bloed bij de start normaal is. Zieke patiënten met bij de start al symptomen waardoor ze veel op bed moeten liggen, hebben een slechtere uitkomst dan fitte patiënten in een uitstekende conditie.
Resultaten van stadiëringsonderzoek
Het is niet goed aan te geven hoe vaak een bepaald type stadium voorkomt. Dit hangt erg af van het type NHL, dat kan variëren van uiterst agressief tot zeer mild, langzaam groeiend. Heel globaal geldt dat hoe langzamer het lymfoom groeit, hoe verder het stadium bij de eerste presentatie van de ziekte gevorderd zal zijn. Dit lijkt tegenstrijdig, maar is toch goed te verklaren: door het sluipende groeigedrag (maanden tot soms jaren) van een weinig agressief NHL merkt het lichaam nauwelijks dat er iets gebeurt, zijn de symptomen vaak zo mild dat een patiënt pas ‘door de mand zal vallen’ bij duidelijke symptomen van de ziekte. Omgekeerd zal een agressief NHL dat zeer snel groeit (in dagen tot weken) veel sneller symptomen geven, waardoor de patiënt zich bij de eerste presentatie nog in een beginstadium van de ziekte bevindt. Natuurlijk zijn er veel uitzonderingen op deze regel.
Meest voorkomende vormen van non-Hodgkin-lymfoom
Hieronder volgt een beschrijving van de meest voorkomende soorten non-Hodgkin-lymfoom. Omdat er zo veel verschillende soorten zijn, is het niet doenlijk ze hier allemaal te beschrijven. Indien nodig kunt u bij de eigen specialist meer informatie vragen. Klik op het type NHL om de beschrijving ervan te lezen.
Diffuus grootcellig B-cellymfoom
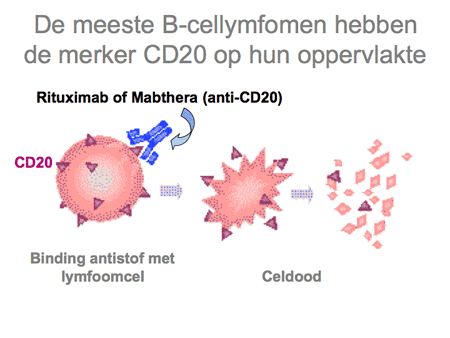
Dit type lymfoom, afgekort als DLBCL, is het meest voorkomende type. Het gedraagt zich agressief met een ontstaans- en groeiwijze in weken tot maanden. Circa een derde van de patiënten presenteert zich met beperkte ziekte, dat wil zeggen één aangedane lokalisatie. Het DLBCL kan ontstaan in een lymfklier, maar ook in vrijwel elk ander orgaan in het lichaam. De ziekte is erg gevoelig voor chemotherapie, waarbij de zogenaamde CHOP-kuren (dia 24) de bekendste zijn. Sinds een aantal jaren wordt aan de CHOP-kuren ook de antistof rituximab (Mabthera, dia 25) toegevoegd, waarmee de geneeskans sterk is verbeterd. Inmiddels zal daarmee de meerderheid van de patiënten kunnen genezen, hoewel er een subgroep blijft bestaan bij wie de uitkomsten minder goed zijn. Hoe ouder (boven de 60 jaar), hoe uitgebreider de ziekte (stadium III-IV), hoe slechter de algemene conditie van een patiënt (bedlegerig) en hoe hoger het serum LDH-gehalte in het bloed, hoe groter de kans dat de ziekte na behandeling terugkomt of zelfs van meet af aan minder goed reageert op de therapie. Dit is dan ook de reden dat er veel HOVON-studies gaande zijn om de resultaten van dit type lymfoom verder te verbeteren.
Een heel globaal therapieschema ziet er als volgt uit:
- Beperkte ziekte: een paar rituximab-CHOP-kuren al dan niet gevolgd door bestraling.
- Uitgebreide ziekte: 6 tot 8 rituximab-CHOP-kuren.
- DLBCL in de hersenen: twee intensieve chemotherapiekuren in het ziekenhuis gevolgd door bestraling.
- DLBCL in de zaadbal (testis): rituximab-CHOP-kuren met tevens beschermende injecties in de ruggemergholte (liquorpuncties) en bestraling op de andere zaadbal.
- DLBCL primair in de huid en nergens anders: alleen bestraling.
Primair mediastinaal B-cellymfoom
Dit type NHL komt nogal eens voor bij jonge vrouwen, hoewel mannen ook door de ziekte getroffen kunnen worden. De ziekte zit voornamelijk in de ruimte achter de longen, vlak bij de zwezerik (het mediastinum), en kan aanleiding geven tot benauwdheid als de luchtpijp ertegenaan zit. Het lastige van dit type NHL is dat er vrijwel altijd een operatie nodig is – waarbij de borstholte geopend moet worden – om de diagnose te stellen. Ook dit type NHL is erg gevoelig voor chemotherapie in de vorm van CHOP-kuren met rituximab. De meeste behandelaars kiezen ervoor om na de chemotherapie een patiënt nog te laten bestralen, om de kans op recidief zo klein mogelijk te maken. In het mediastinaal B-cellymfoom zit veel bindweefsel, waardoor het erg lang duurt voor een zwelling kleiner wordt, wat het soms moeilijk maakt om met zekerheid aan te geven of de ziekte echt weg is. Gelukkig is dit bij de meeste patiënten wel het geval aan het einde van de therapie. Nieuwe technieken, zoals de PET-scan of PET/CT-scan, zijn hierbij erg behulpzaam.
Burkitt-lymfoom
Van alle typen NHL is dit een van de snelst groeiende tumoren. Patiënten met een Burkitt-lymfoom zullen bijna altijd meteen opgenomen moeten worden in een centrum om zo snel mogelijk intensieve chemotherapie te kunnen ontvangen. Zij moeten daarbij goed voorbereid worden, omdat de therapie tot flinke tumorafbraak kan leiden, wat nierschade zou kunnen veroorzaken. Burkitt-lymfomen hebben een voorkeur voor lokalisaties in het zenuwweefsel en de hersenen, zodat daar met de therapie rekening mee gehouden moet worden. Mits goed en snel behandeld is ook deze zeer agressieve ziekte bij de meerderheid van de patiënten inmiddels te genezen. Het is niet goed mogelijk precies aan te geven wat de behandeling inhoudt, omdat die sterk bepaald wordt door de uitgebreidheid van de ziekte en de leeftijd en conditie van de patiënt. Een flink deel van de behandeling moet in het ziekenhuis gegeven worden, waardoor de patiënt meerdere malen enige weken moet worden opgenomen.
Folliculair lymfoom
Het folliculair lymfoom is het op een na meest voorkomende type lymfoom. Artsen noemen het vaak een ‘laaggradig’ lymfoom, omdat het een mild, indolent (langzaam groeiend) gedrag vertoont. Het heeft een aantal bijzondere kenmerken die ook de behandeling sterk bepalen. Het groeit zeer langzaam en heeft een voorkeur voor lokalisaties in de lymfklieren, de milt en vooral het beenmerg. Bij patiënten blijkt de ziekte vaak al veel uitgebreider te zijn dan aanvankelijk gedacht, omdat de ziekte op veel plaatsen nauwelijks symptomen veroorzaakt. Patiënten met een folliculair lymfoom hebben een levensverwachting van vele, vaak tientallen jaren, maar zullen meestal niet genezen kunnen worden.
Het folliculair lymfoom reageert goed op chemotherapie (die tegenwoordig wordt gecombineerd met de antistof rituximab), zelfs op zeer licht gedoseerde chemotherapie (bijvoorbeeld leukerantabletten met rituximab-infuus), maar heeft de hardnekkige eigenschap vroeg of laat weer terug te komen. Opnieuw behandelen is dan wederom succesvol, maar er komt in de loop der jaren vaak toch een moment dat de ziekte minder gevoelig wordt voor chemotherapie of gaat veranderen en zich agressiever gaat gedragen. Dit laatste heet ook wel transformatie, waardoor het NHL zich meer als een diffuus grootcellig B-cellymfoom gaat gedragen. Op dat moment moet de behandeling ook intensiever worden en zullen patiënten CHOP-kuren (zie dia 24 en 25) krijgen of zelfs stamceltransplantatie.

Dia 24

Dia 25
Dia 26
Het folliculair lymfoom is bij uitstek de ziekte waar het begrip ‘wait and see’ (afwachten) op van toepassing is: een beleid waar zelfs een patiëntengroep actief naar vernoemd is. De bedoeling van ‘wait and see’ is dat patiënten niet meteen behandeld worden met bijvoorbeeld chemotherapie of antistoffen, maar zorgvuldig onder controle blijven en pas met behandeling starten wanneer symptomen dat noodzakelijk maken. De gedachte hierachter is gebaseerd op het feit dat een eerdere behandeling weliswaar het lymfoom zal doen slinken, maar dat dit niet levensverlengend zal werken.
Omdat het moeilijk te verteren blijft dat dit type non-Hodgkin-lymfoom, weliswaar niet zo agressief, toch uiteindelijk onbehandelbaar zal blijken te zijn, worden er wereldwijd veel studies gedaan om te zien of de behandelingsresultaten niet kunnen verbeteren. Ook in Nederland is men daar zeer actief bij betrokken, onder meer binnen HOVON-verband. Belangrijke elementen bij deze studies zijn erop gericht te voorkomen dat de ziekte terugkomt. Daarbij gaat het vooral om behandelingsvormen zoals een soort van onderhoudstherapie na afloop van de eerste chemotherapiekuren. Een bekende vorm van onderhoudsbehandeling is bijvoorbeeld die met rituximab, waarbij elke 2 of 3 maanden één infuus met rituximab gegeven wordt in de hoop dat het lymfoom langer weg blijft.
Lymfocytair lymfoom / chronisch lymfatische leukemie
Patiënten met dit type lymfoom hebben vaak een beeld dat sterk lijkt op dat van chronisch lymfatische leukemie (CLL). Ook dit type lymfoom wordt gerekend tot de ‘laaggradige’ lymfomen, een oude terminologie waarmee het weinig agressieve karakter aangeduid wordt. Wanneer de lymfklieren aangedaan zijn, is het voor de patholoog onder de microscoop een identiek beeld. Bij de ene patiënt zullen de NHL/CLL-cellen vooral in de klieren gaan zitten en ziet het er meer uit als een lymfklierziekte; bij de andere patiënt zitten de cellen vooral in het bloed en het beenmerg en lijkt de ziekte meer op een chronische leukemie. In beide gevallen gaat de ziekte van dezelfde kwaadaardige cellen uit, die dus soms meer de voorkeur hebben voor klieren en weefsels en in het andere geval liever rondzwemmen in het bloed. De behandeling is ook hetzelfde en zal pas starten als het echt nodig is, omdat dit type lymfoom niet goed te genezen is. De meeste patiënten met een lymfocytair lymfoom of CLL leven hier tientallen jaren mee; aangezien de ziekte bovendien vaak op oudere leeftijd voorkomt, zullen de meeste patiënten uiteindelijk aan andere, meer bekende oorzaken zoals hart- en vaatziekten of andere vormen van kanker overlijden dan aan deze ziekte.
MALT-lymfoom van de maag, speekselklier of elders
MALT staat voor mucosa-associated lymphoid tissue, dat wil zeggen: slijmvlies-geassocieerd lymfweefsel. Hiermee wordt bedoeld het lymfweefsel dat van nature aanwezig is in de maag en de darmen, maar ook aangetroffen kan worden in het slijmvlies van de luchtwegen, de speekselklieren, traanklieren of ogen. Dit lymfweefsel kan kwaadaardig worden, vandaar de naam MALT-lymfomen.
MALT-lymfomen worden over het algemeen gerekend tot de weinig kwaadaardige vormen van lymfklierkanker. Ze groeien zeer langzaam, verspreiden zich niet zo vaak en kunnen soms door een operatie al behandeld worden. Een afwachtend beleid, behandeling met laaggedoseerde bestraling of behandeling met de antistof rituximab is soms al voldoende. Hoewel de meerderheid van de patiënten met dit type lymfoom dus weinig problemen zal ervaren, kan het bij een kleine minderheid met meer lymfoomlokalisaties toch nodig zijn meer behandeling te geven. Meestal zal het dan gaan om de combinatie van chemotherapie met bij voorkeur weer rituximab.
Het MALT-lymfoom in de maag is hierbij zeer bijzonder. Het blijkt namelijk een sterke relatie te hebben met de bacterie Helicobacter Pylori, die maagzweren en maagontsteking veroorzaakt. Kennelijk ontstaat bij zeldzame patiënten in aansluiting op een infectie met deze bacterie een soort uit de hand gelopen afweerreactie waarbij het lymfweefsel overactief wordt en daarbij zodanig kan ontsporen dat het kenmerken van kwaadaardigheid krijgt. Het goede nieuws hierbij is dat intensieve behandeling van de bacterie (onder meer met antibiotica) resulteert in een langzaam (weken tot soms vele maanden) verdwijnen van het lymfoom. Patiënten met een maag-MALT-lymfoom worden dus (vaak tot hun verbazing) in eerste instantie behandeld met antibiotica in plaats van met chemotherapie.
Mantelcellymfoom
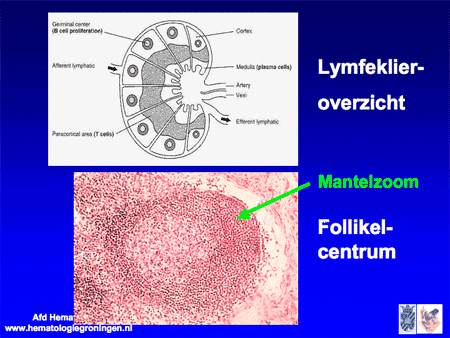
De naam mantelcellymfoom stamt af van de normale opbouw van een lymfklier, waarin rondom onderdelen binnen in een lymfklier zomen van cellen worden aangetroffen die ook wel mantelcellen genoemd worden (zie dia 17).
Dia 17
Het mantelcellymfoom is zeldzaam (circa 5 procent van alle NHL-soorten). Het is karakteristiek een ziekte van ouderen en komt vaker voor bij mannen dan bij vrouwen. Bij de meeste patiënten is bij de ontdekking al sprake van uitgebreide ziekte (stadium IV), waarbij er kwaadaardige cellen in het beenmerg zitten, soms ook in het bloed, vaak in de milt en daarnaast in meerdere lymfklieren.
De behandelingsresultaten zijn tot op heden nog niet zo goed als die van bijvoorbeeld het agressieve B-cellymfoom. Tot een jaar of tien geleden had deze ziekte een sombere prognose. Het lukte zelden de ziekte weg te krijgen, en als dat wel lukte, kwam deze altijd weer terug. Dankzij een groot Europees consortium worden er sinds het einde van de vorige eeuw studies gedaan, waarbij veel landen met elkaar samenwerken. Deze studies hebben opgeleverd dat inmiddels de levensverwachting van niet alleen de jongere patiënten, maar ook die van patiënten ouder dan 65 jaar met meerdere jaren is verlengd. Er is zelfs hoop dat het gaat lukken om bij een kleine groep de ziekte vele jaren (blijvend?) onder controle te krijgen. Tot op heden is het nog niet mogelijk te voorspellen hoe patiënten op de behandeling zullen reageren.
Anders dan bij het folliculair lymfoom is het niet gebruikelijk een wait-and-seebeleid te voeren, maar patiënten meteen bij de diagnose een behandeling aan te bieden. Bij de behandeling wordt meestal onderscheid gemaakt tussen ‘jongeren’, dat wil zeggen patiënten waarvan aangenomen wordt dat zij zware chemotherapie kunnen ondergaan inclusief een stamceltransplantatie, en ‘ouderen’, die weer onderscheiden kunnen worden in fitte oudere patiënten en kwetsbare ouderen. Jongeren (jonger dan 65 jaar) krijgen bij de start chemotherapie met de antistof rituximab, deels poliklinische kuren (R-CHOP), deels kuren die een ziekenhuisopname vereisen (hoge dosis cytarabine). Vervolgens is het gebruikelijk de behandeling te beëindigen met zeer hoge dosis chemotherapie gevolgd door autologe stamceltransplantatie, gebruikmakend van de eigen bloedstamcellen. In Nederland loopt een studie (HOVON 75) waarbij onderzocht wordt of het voldoende is om dan te stoppen met behandelen of dat het zinvol is door te gaan met een onderhoudsbehandeling met het middel bortezomib. Het doel van dit laatste is om de kans dat de ziekte terugkomt zo klein mogelijk te maken.
Voor de oudere patiënten is in 2010 een grote Europese studie (onderdeel voor Nederland was daarbij de HOVON 55-studie) afgerond waarbij verschillende beginkuren met elkaar vergeleken werden, gevolgd door verschillende onderhoudsschema’s. Uit die studie is gebleken dat patiënten ouder dan 65 jaar het meeste baat hebben bij een behandeling met R-CHOP-kuren. Wanneer zij daar vervolgens goed op reageren (dat wil zeggen, een volledige of gedeeltelijke remissie bereiken), is het zeer de moeite waard om door te gaan met een onderhoudsbehandeling met de antistof rituximab, één gift elke 2 maanden, liefst zo lang mogelijk. Binnenkort zullen er nieuwe studies voor de oudere patiënten starten. Voor de fitte ouderen zal onderzocht worden of het mogelijk is de beginkuren te verzwaren door ook het middel cytarabine (in sterk aangepaste dosis) toe te voegen, zoals ook bij jongeren standaard is. Ook wordt onderzocht of de onderhoudsbehandeling nog verder verbeterd kan worden door niet alleen rituximab toe te dienen, maar daaraan ook het middel lenalidomide toe te voegen. Het UMCG werkt actief mee aan studies voor mantelcellymfoom, omdat dit de enige methode lijkt te zijn om de vooruitzichten van patiënten met een mantelcellymfoom verder te verbeteren. Met de toepassing van meerdere nieuwe middelen ziet de toekomst voor patiënten met deze ziekte er veel minder somber uit dan in het verleden het geval was.
Lymfoplasmacytair lymfoom / ziekte van Waldenström
Bekijk hier de PowerPoint-presentatie over Waldenström.
Dit type lymfoom wordt niet door iedereen als een non-Hodgkin-lymfoom beschouwd, terwijl het toch echt wel een NHL is. Het wordt gerekend tot de groep van de mild kwaadaardige (in de oude terminologie ‘laaggradige’) lymfomen, omdat de groei zeer langzaam is. Het bestaat uit een woekering van lymfocyten en uitgerijpte lymfocyten (plasmacellen) die een overmaat van één type eiwit maken (een zogenaamd monoclonaal eiwit, M-proteïne of paraproteïne). Hoe meer van dit type cellen er zijn, hoe meer eiwit in het bloed gevonden kan worden. De cellen bevinden zich vrijwel steeds in het beenmerg, maar kunnen ook aangetroffen worden in de milt, die daardoor vergroot kan zijn, en soms ook in de lymfklieren. Als de ziekte uitgebreid in het beenmerg aanwezig is, kan dit aanleiding geven tot een verdringing van de normale bloedaanmaak met bloedarmoede, een daling van het aantal normale witte bloedcellen en een tekort aan de trombocyten (bloedplaatjes). Meestal is de beenmergaantasting echter gering en zal er alleen een lichte vorm van bloedarmoede zijn, waar de meeste patiënten weinig tot niets van merken. De ziekte lijkt soms een beetje op een andere kwaadaardige aandoening, het multipel myeloom/de ziekte van Kahler. Bij het multipel myeloom is er sprake van een woekering van uitsluitend plasmacellen met eiwitproductie. Vandaar dat patiënten met Waldenström soms gelinkt worden aan patiënten met een multipel myeloom, terwijl het echt om heel verschillende aandoeningen gaat.
De laatste jaren worden de termen ‘ziekte van Waldenström’ en ‘lymfoplasmacytair lymfoom’ door elkaar gebruikt. De meeste patiënten met een lymfoplasmacytair lymfoom maken namelijk een beetje monoclonaal eiwit in het bloed aan, maar de meesten merken hier niets van. Het is een makkelijke merker in het bloed om een indruk te krijgen van de ziekteactiviteit: hoe meer lymfoom, hoe meer eiwit.

De ontdekker van het lymfoplasmacytair lymfoom.
De symptomen van een lymfoplasmacytair lymfoom variëren van vrijwel geen symptomen (zie sluimerende Waldenström), via symptomen van moeheid, een pijnlijk vergrote milt, gewichtsverlies, krachtsverlies met tintelingen in de benen en voeten (neuropathie) tot ernstige symptomen van hyperviscositeit. Dit laatste symptoom, een mooi woord voor toegenomen stroperigheid van het bloed, wordt veroorzaakt door het hoge eiwitgehalte (bijvoorbeeld meer dan 60-70 gram/liter), waardoor het bloed zo dik (viskeus) wordt dat het daardoor in de kleine bloedvaten in de ogen, de hersenen en de longen niet meer goed kan stromen. Vervolgens kan een patiënt moeite krijgen met zien, kortademig zijn bij inspanning, hoofdpijn krijgen, sneller last krijgen van een bloedingsneiging of symptomen van verwardheid ontwikkelen. Als deze symptomen aanwezig zijn, is snel behandelen aangewezen. De therapie zal dan bestaan uit plasmaferese, waarbij het bloed van de patiënt wordt geleid door een machine die het eiwit verwijdert. In combinatie met plasmaferese krijgt een patiënt tevens chemotherapie in combinatie met de antistof rituximab om tegelijkertijd de eiwitaanmaak te blokkeren.
De chemotherapie kan bestaan uit het al vele jaren toegepaste chloorambucil (leukeran), R-CVP-kuren of modernere middelen zoals fludarabine of bortezomib. Omdat de ziekte zeldzaam is, zijn er ook nooit vergelijkende studies gedaan waarbij de ene therapie vergeleken kon worden met de andere. Bij patiënten met een erg hoog eiwitgehalte is het zaak voorzichtig te zijn met het gebruik van rituximab, omdat dit middel tijdelijk het eiwitgehalte verder kan verhogen (zogenaamde flare-up). Toch moet de behandeling wel worden voortgezet om uiteindelijk de meeste winst te kunnen boeken. Dit is ook een reden om bij een hoog eiwitgehalte het middel rituximab te combineren met chemotherapie. Fludarabine is een zeer effectief middel, maar geeft een sterk verhoogde kans op infecties.
Aangezien veel patiënten met een lymfoplasmacytair lymfoom weinig of geen klachten hebben, en alleen bij bloedonderzoek door de mand gevallen zijn (het verhoogde eiwitgehalte gaat meestal gepaard met een verhoogde bloedbezinking), wordt bij velen afgewacht (‘wait and see’-beleid). Deze vorm van lymfoplasmacytair lymfoom wordt ook wel sluimerende Waldenström genoemd. Bij deze patiënten blijft de ziekte vele jaren zonder symptomen. Gemiddeld zal per jaar slechts 4 procent van de patiënten symptomen ontwikkelen die behandeling behoeven.
Het lymfoom is niet te genezen. Ook al zal het goed reageren op een ingestelde behandeling, het zal na het stoppen van de therapie altijd weer terugkomen. Desalniettemin hebben patiënten met dit type lymfoom een levensverwachting van vele (vaak tientallen) jaren. De prognose (levensverwachting in jaren) wordt vooral bepaald door de aan- of afwezigheid van symptomen. Hoe meer symptomen (met name ernstige bloedarmoede, een hoog M-proteïnegehalte van meer dan 40 gram/liter), hoe minder lang de levensverwachting zal zijn.
Voor patiënten met dit type lymfoom is:
Stichting Hematon
Postbus 8152
3503 RD Utrecht
Tel. 030-760 34 60
E-mail: secretariaat@hematon.nl
Website: www.hematon.nl
Lymfoom bij afweerstoornissen / post-transplantatielymfoom
Patiënten met aangeboren afweerstoornissen (meestal kleine kinderen) en patiënten die vanwege medicatiegebruik een stoornis in de afweer hebben, kunnen een non-Hodgkin-lymfoom ontwikkelen dat zich erg agressief kan gedragen. Het gaat hier om zeer zelden voorkomende situaties, ondanks het feit dat er heel vaak medicijnen gebruikt worden die de afweer onderdrukken. Dit type non-Hodgkin-lymfoom kan voorkomen bij patiënten die een nier-, lever-, darm-, long- of harttransplantatie ondergaan hebben. Tot enige jaren terug kwam dit type lymfoom ook regelmatig voor bij patiënten met aids (besmetting met het HIV-virus). Het lymfoom kan zich overal ontwikkelen, maar heeft wel voorkeursgebieden, zoals de hersenen, of juist in het getransplanteerde orgaan. Het bijzondere van dit type lymfoom, waarbij nogal eens een besmetting met een specifiek virus (EBV, het Epstein Barr-virus, de veroorzaker van de ziekte van Pfeiffer) een rol speelt, is dat het vanzelf weer kleiner kan worden als het lukt de afweer te verbeteren. Daarnaast is de antistof rituximab ook van groot belang. Als er na vermindering van de afweermedicijnen (in het geval van orgaantransplantatie) en toediening van rituximab nog steeds lymfoomactiviteit is, moet met chemotherapie gestart worden. In dat laatste geval is de prognose ook minder goed.
Perifeer T-cellymfoom
Dit type lymfoom komt veel minder voor dan de lymfomen van het B-celtype. Het is moeilijk te behandelen, omdat het minder goed reageert op chemotherapie en ook erg snel weer terugkomt. Binnen Europa is een netwerk opgericht om speciale behandelstudies te doen voor dit type lymfoom, om daarmee de kans van slagen te vergroten. De afdeling Hematologie van het UMCG doet hieraan mee. Patiënten jonger dan 60 tot 65 jaar zullen behandeld worden met CHOP-kuren, al dan niet in combinatie met de antistof alemtuzumab (de HOVON 90-studie). Na 6 kuren eindigt de behandeling met hoge-dosis-chemotherapie gevolgd door autologe stamceltransplantatie. Oudere patiënten worden met dezelfde CHOP-kuren behandeld, eveneens al dan niet met de antistof alemtuzumab (de HOVON 91-studie), maar zullen niet de transplantatie aangeboden krijgen. Patiënten die niet in de bovengenoemde studies behandeld worden dienen – als <60 jaar – bij voorkeur behandeld te worden met 2-wekelijkse kuren volgens het CHOP of CHOEP schema gevolgd door autologe stamceltransplantatie; de patiënten >60 jaar worden nog steeds behandeld met 6 CHOP kuren, elke 3 weken toe te dienen.
Overige T-cellymfomen
Er zijn nog andere typen agressief T-cellymfoom, die stuk voor stuk erg zeldzaam zijn. Een korte opsomming volgt hieronder. De behandeling is in principe gelijk aan die van het perifeer T-cellymfoom (zie hierboven).
- Angio-immunoblastair T-cellymfoom: vaak uitgebreide ziekte bij de eerste presentatie. Dit lymfoom gaat nogal eens gepaard met huiduitslag na geneesmiddelen en met ziekten die ‘auto-immuunziekten’ worden genoemd, zoals auto-immuun hemolytische anemie. Bij sommige patiënten speelt het EBV-virus een rol. Deze patiënten hebben er mogelijk baat bij als aan de chemotherapie ook rituximab wordt toegevoegd.
- Enteropathie-geassocieerd T-cellymfoom (EATL): meestal in de darm en vrijwel steeds in samenhang met de ziekte coeliakie (vlokatrofie). Vaak zijn de patiënten te ziek of te vermagerd om een goede behandeling te kunnen ondergaan.
- Anaplastisch grootcellig lymfoom (ALCL): heeft binnen de groep van T-cellymfomen een betere prognose, vooral de groep waarin het zogenaamde ALK-eiwit tot expressie komt. Bij deze laatste groep wordt dan ook afgezien van hoge-dosis-chemotherapie en stamceltransplantatie. Met de ontwikkeling van een nieuwe antistofbehandeling specifiek gericht tegen de CD30-merker op ALCL-cellen (brentuximab vedotin) zal het in de toekomst waarschijnlijk mogelijk zijn om patiënten met een ALCL beter te gaan behandelen
- NK/T-cellymfoom van de neus: komt meestal voor bij patiënten uit Azië, maar kan ook in Nederland voorkomen. Bestraling is een belangrijk onderdeel van de behandeling. Als de ziekte uitgebreider is wordt geadviseerd intensieve chemotherapie te geven met medicijnen zoals asparaginase en methotrexaat. Mocht de patient goed in remissie komen, dan is een eventuele allogene stamceltransplantatie te overwegen.
- Hepatosplenaal gamma/delta-lymfoom: een gelukkig uiterst zeldzaam, en zeer agressief lymfoom waarbij lever, milt en vaak ook het beenmerg betrokken zijn. Komt nogal eens voor bij jonge patiënten die behandeling krijgen met afweerremmende therapie.
- Subcutaan panniculitis-like T-cellymfoom. Hierbij worden twee vormen onderscheiden: een vorm van het zogenaamde alfa/beta-type waarbij therapie met alleen prednison vaak al voldoende is, en een vorm van het zogenaamde gamma/delta-type, waarbij wel intensieve behandeling met chemotherapie nodig is, mogelijk zelfs gevolgd door allogene stamceltransplantatie. Beide typen zijn overigens zeer zeldzaam.
Primair lymfoom van de huid / mycosis fungoides
Huidlymfomen zijn er in veel verschillende typen. Ze kunnen eruitzien als eczeem, maar kunnen ook een plaatselijke zwelling veroorzaken. De diagnose en behandeling vereisen veel ervaring. Gelukkig is er in Nederland een landelijke werkgroep cutane (cutis = huid) lymfomen, waarin alle patiënten uit het hele land maandelijks besproken worden door een zeer deskundig team van gespecialiseerde huidartsen, radiotherapeuten en pathologen. Huidlymfomen laten zich in de meeste gevallen goed behandelen en de prognose is in veel gevallen uitstekend.
Behandeling van non-Hodgkin-lymfoom in het algemeen
Er is niet één type behandeling, gezien de grote diversiteit van NHL-soorten en NHL-patiënten. Belangrijk is te weten dat een deel van de patiënten genezen kan worden. Met genezen wordt bedoeld: het NHL-lymfoom is vernietigd, waarna het nooit meer terugkomt. Dit is dan ook bij deze groep het belangrijkste doel. Maar er zijn ook vormen van NHL die zich niet zo kwaadaardig gedragen en niet altijd behandeling behoeven, of waarbij de behandeling wel zal aanslaan, maar waarbij van tevoren al te voorspellen is dat de ziekte vroeg of laat altijd weer terugkomt. In dat laatste geval is het niet altijd vanzelfsprekend om meteen met therapie te starten, zeker niet als een patiënt nauwelijks klachten heeft.

Dia 18

Dia 19

Dia 20

Dia 21

Dia 22

Dia 23
De behandeling hangt af van vijf belangrijke zaken:
- het soort NHL (wat de patholoog ons vertelt, hoe het eruitziet onder de microscoop);
- de primaire lokalisatie (eenzelfde NHL in de huid wordt anders behandeld dan wanneer dit in een lymfklier of bijvoorbeeld in de maag begint);
- het stadium van de ziekte;
- het risicoprofiel van de patiënt, inclusief diens leeftijd;
- de aanwezigheid van eventuele andere ziekten, die een NHL-behandeling zouden kunnen bemoeilijken.
De behandeling, als deze nodig is, kan dus pas vastgesteld worden als een patiënt eerst uitgebreid onderzoek heeft ondergaan. Dit onderzoek kost tijd (minstens twee tot drie weken) en dat leidt daarmee tot een lange onzekere periode, wat echter onvermijdelijk is. In die wachttijd kunnen soms wel vast voorbereidingen getroffen worden om vervolgens de eventuele behandeling zo goed mogelijk te kunnen ondergaan. Hoe beter de conditie van een patiënt, hoe beter de behandeling zal aanslaan en verdragen kan worden. Eventueel gewichtsverlies kan vast met extra dieet gecorrigeerd worden. Als een patiënt rookt, dient deze serieus te proberen daarmee te stoppen. Hoewel de meeste NHL-chemotherapieschema’s de vruchtbaarheid niet blijvend aantasten, adviseren wij mannelijke patiënten (als er een kinderwens is) altijd voor de zekerheid van tevoren toch zaadcellen in te laten vriezen. Ook dit is iets wat in de tussentijd alvast georganiseerd kan worden.
De duur van de behandeling verschilt per type NHL, per stadium van de ziekte en per risicoprofiel van de patiënt en kan variëren van een paar maanden tot wel een half jaar. In sommige gevallen wordt aan het eind van de behandeling nog doorgegaan met een onderhoudsbehandeling om de kans op terugkomst van het NHL verder te verkleinen. Hoewel een patiënt soms bij de start opgenomen moet worden, zal een groot deel poliklinisch behandeld kunnen worden. De behandeling bestaat meestal uit celdodende medicijnen in de vorm van chemotherapiekuren, die soms uit tabletten bestaan, maar ook uit middelen die alleen via de bloedbaan gegeven kunnen worden, waarbij elke twee, drie of vier weken een infuus wordt toegediend op de dagbehandelingsafdeling. Elke patiënt krijgt vanzelfsprekend uitgebreid informatie over het soort therapie inclusief de bijbehorende bijwerkingen.
Non-Hodgkin-lymfoombehandeling en HOVON-studies
Hoewel de behandelingsresultaten de laatste jaren sterk zijn verbeterd, zijn we nog niet tevreden. Zolang niet alle patiënten uiteindelijk kunnen genezen, valt er nog veel te doen. Daarom streven wij ernaar alle patiënten waar mogelijk in studieverband te behandelen. Bij elke studie wordt getracht de behandeling verder te verbeteren. In een dergelijke studie is het principe dat er twee of drie behandelingsmogelijkheden zijn. Daarbij wordt de potentieel betere behandeling vergeleken met de – tot nu toe – beste zogenaamde gouden standaardtherapie. Als een patiënt toestemming geeft voor een dergelijke studie, zal het lot vervolgens bepalen welk behandelingsschema wordt gegeven.
Soms zijn we te optimistisch en blijkt de potentieel betere behandeling niet beter te zijn en een enkele keer zelfs meer bijwerkingen te veroorzaken dan de therapie tot dusver. Gelukkig gaat het vaak ook goed en blijken we stapje voor stapje (per studie) kleine verbeteringen te kunnen aanbrengen. Dit is dan ook de reden dat de geneeskansen van bijvoorbeeld het diffuus grootcellig B-cellymfoom de laatste jaren zo verbeterd zijn en dat de overleving van andere – niet te genezen lymfoomtypen – toch met vele jaren is verlengd. Wij vinden het daarom erg belangrijk dat dit soort studies uitgevoerd worden. De afdeling Hematologie van het UMCG werkt actief aan al deze HOVON-studies mee. De kans is dan ook groot dat een nieuwe patiënt met een NHL met de vraag wordt geconfronteerd of deze mee wil doen aan een lopende NHL-studie. Alle informatie over zo’n studie wordt altijd op schrift verstrekt en er is meestal ruim bedenktijd voor een dergelijke belangrijke beslissing.
Follow-up na behandeling
Tijdens en na de behandeling vindt wederom onderzoek plaats om vast te leggen of het non-Hodgkin-lymfoom goed reageert op de ingestelde therapie. Dit betekent dat er scans of andere onderzoeken herhaald worden halverwege en aan het eind van de therapie. Het eerste jaar na behandeling zullen de controles intensief zijn (elke twee maanden), in de jaren erna neemt de intensiviteit af, totdat na vijf jaar de controles nog maar één keer per jaar hoeven plaats te vinden. In principe dient een patiënt levenslang gecontroleerd te worden, de eerste jaren om een eventuele terugkomst van het non-Hodgkin-lymfoom op te sporen en in de jaren daarna gericht op eventuele late bijwerkingen veroorzaakt door de behandeling.
Wat als het non-Hodgkin-lymfoom na behandeling terugkomt of onvoldoende reageert op chemotherapie?
De kans dat dit gebeurt hangt sterk af van het type lymfoom en van de uitgebreidheid bij de start van de behandeling. Aan patiënten met een agressief type NHL dat goed gevoelig is voor chemotherapie wordt dan een nieuwe behandeling aangeboden die zwaarder zal zijn dan de oorspronkelijke, om alsnog een geneeskans mogelijk te maken. Voor die patiënten, mits jonger dan 65-70 jaar en in een acceptabele conditie, zal zo’n vervolgbehandeling meestal bestaan uit hoge dosis chemotherapie gevolgd door autologe stamceltransplantatie, gebruikmakend van de stamcellen van de patiënt zelf. Dit is een ingewikkelde procedure die niet zomaar gestart wordt en waarbij het erg belangrijk is dat er goede voorlichting wordt gegeven en goede voorbereidingen worden genomen. Bij voorkeur wordt een dergelijke behandeling ook in studieverband uitgevoerd.
Conclusie
Het non-Hodgkin-lymfoom omvat een grote groep van kwaadaardige lymfklierziekten met een enorme variëteit aan soorten. Niet één patiënt is hetzelfde en de kale diagnose ‘non-Hodgkin-lymfoom’ zonder extra informatie over welk type het betreft, is onvoldoende om goede voorlichting te kunnen geven. Niet alleen het type, maar ook de presentatie, de lokalisatie(s) in het lichaam en de conditie van de patiënt zijn belangrijke factoren die bepalen hoe de toekomst voor een dergelijke patiënt eruit zal zien. Elke patiënt wordt eerst goed in kaart gebracht door middel van een stadiëringsonderzoek, waarna een eventuele behandeling kan starten. Deze zal meestal bestaan uit chemotherapie met antistoffen, al dan niet gevolgd door bestraling. De meeste patiënten worden in studieverband behandeld. Na de behandeling blijft een patiënt levenslang onder controle.

Dia 27

Dia 28

Dia 29
Meer weten?
Patiëntenvereniging
Er is een zeer actieve patiëntenvereniging die veel en goed voorlichtingsmateriaal biedt. Deze patiëntenvereniging is onderdeel van de overkoepelende vereniging HEMATON voor patiënten met bloedkanker, lymfklierkanker, en patiënten die een stamceltransplantatie ondergingen.
Stichting Hematon
Postbus 8152
3503 RD Utrecht
Tel. 030-760 34 60
E-mail: secretariaat@hematon.nl
Website: www.hematon.nl
Revalidatieprogramma Herstel & Balans
Daarnaast is er voor patiënten die de behandeling achter de rug hebben en moeite hebben de draad weer op te pakken, de mogelijkheid gebruik te maken van het revalidatieprogramma Herstel & Balans. Dit programma is op zestig locaties in Nederland beschikbaar, onder meer ook in het UMCG, via het Centrum voor Revalidatie, locatie Beatrixoord. Dit programma is gericht op het verminderen van klachten zoals vermoeidheid, pijn, angst en neerslachtigheid. Daardoor verbetert de kwaliteit van leven.
Een (ex-)patiënt kan aan Herstel & Balans deelnemen nadat de behandelingen tegen kanker zijn afgerond. Bij de start van de revalidatie moet de conditie zodanig zijn dat de persoon zich redelijk kan bewegen en aan het groepsprogramma kan deelnemen. De arts kan de patiënt verwijzen naar Herstel & Balans als de behandeling is afgerond en de kans op herstel aannemelijk is.
Zie ook: Oncologische revalidatie.
Nazorg: Het Behouden Huys
Het valt niet altijd mee om met een ziekte als kanker om te gaan. Er komt verschrikkelijk veel op je af. Eerst de klap van de diagnose, dan de vaak ingrijpende medische behandelingen. En hoe verder daarna? Hoe ga je bijvoorbeeld om met een veranderd lichaam, met vermoeidheid of een onzeker levensperspectief? Het kan daarom heel wenselijk zijn om na(ast) de medische zorg gebruik te maken van extra ondersteuning door Het Behouden Huys.
Het Behouden Huys is gelegen op het prachtige landgoed De Vijverberg te Haren. Het is een bijzondere plek waar kankerpatiënten en hun naasten onder professionele en vooral ook betrokken begeleiding stil kunnen staan bij de lichamelijke, psychische en sociale gevolgen van hun ziekte. Er is begeleiding mogelijk voor iedereen, ongeacht de leeftijd, ziektefase, prognose of het stadium van het ziekteproces.
Wilt u meer weten, zie dan: www.behoudenhuys.nl.




